
����Ŀ����ѧ��Ӧ�е������仯�������ȡ��������Ҫ;����
��1��Һ������һ����Ҫ�ļ�ͥȼ�ϣ�����ʾ��ͼ��Һ������ȼ�չ����е������仯���������___
A.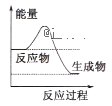 B.
B. C.
C.
��2�������ձ�ʹ�õĸɵ�ع���ʱ�ǽ���ѧ��ת��Ϊ___��
��3����֪��1molH2�еĻ�ѧ��Ҫ����436kJ����������1molO2�еĻ�ѧ��Ҫ����496kJ���������γ�ˮ�����е�1molH��O��Ҫ�ų�463 kJ���������Լ���2H2+O2=2H2O��Ӧ�е���H=___kJ��mol-1��
��4������������ԭ��Ӧ��2Ag+��aq��+Cu��s��=Cu2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ����ش��������⣺

�ٵ缫X�IJ�����___���������ҺY��___��
�����缫Ϊ��ص�___���������ĵ缫��ӦΪ___��X�缫�Ϸ����ĵ缫��ӦΪ___��
������պϵ�·ǰX�缫�����缫������ȣ�����·��ͨ��0.1mol����ʱ�����缫������Ϊ___g����ԭ����Cu��64��Ag��108��
���𰸡�A ���� -484 ͭ ��������Һ �� Ag++e-=Ag Cu-2e-=Cu2+ 14
��������
ԭ�����������������ɵģ����ݵ�ط�Ӧʽ2Ag+��aq��+Cu��s��=Cu2+��aq��+2Ag��s�� �жϣ�ͭ�Ǹ���������������������ͭʧ���ӷ���������Ӧ�������������ӵõ��ӷ�����ԭ��Ӧ����ͭ��Ӧ���ں���ͭ���ӵĿ���������Һ�У������ں��������ӵĿ�����������Һ�У����ӴӸ����ص����������������ݴ˷������н��
��1��Һ����ȼ���Ƿ��ȷ�Ӧ����Ӧ��������Ӧ�ø������������������ʴ�ѡA��
�ʴ�ΪA��
��2�������ձ�ʹ�õĸɵ�ع���ʱ��������ԭ���ԭ��������ѧ��ת��Ϊ���ܡ�
�ʴ�Ϊ ����
��3��2H2+O2=2H2O��Ӧ��2molH2�еĻ�ѧ������Ҫ����436kJ��2=872KJ������1mol O2�еĻ�ѧ����������496kJ������2molH2O�к���4molH-O�����ʳɼ��ų�463��4KJ=1852KJ���������ʷų�������=1852-496-872=484kJ������H= - 484 kJ��mol-1
�ʴ�Ϊ -484
��4����ͭ�Ǹ���������������XΪͭ��Ӧ���ں���ͭ���ӵĿ���������Һ�У������ں��������ӵĿ�����������Һ�У�Y�ǿ�����������Һ��Ϊ��������Һ��
�����������������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��Ag++e-=Ag��X��Ϊ��������������Ӧ��������ӦΪCu-2e-=Cu2+��
�������缫��ӦʽΪ��Ag++e-=Ag��֪ͨ��0.1mol����ʱ������������Ϊ0.1��108=10.8g������ͭ�缫��ӦΪCu-2e-=Cu2+��ͨ��0.1mol��������ͭ������Ϊ0.1��0.5��64=3.2g�������缫������Ϊ10.8��3.2g=14g��
�ʴ�Ϊ ͭ ��������Һ �� Ag++e-=Ag Cu-2e-=Cu2+ 14


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+(aq)+ Cu(s) = Cu2+(aq)+ 2Ag(s) ��Ƶ�ԭ�������ͼ��ʾ����������Ϊ��֬�C����KNO3���š���ش��������⣺
(1)�缫X�IJ����� ___________���������ҺY�� ____________________��
(2)���缫Ϊ��ص� __________ ������缫��ӦʽΪ��___________________________________ ��
(3)��������CuSO4��Һ��Ǩ�Ƶ������� ___________��

A��K+ B��NO3�D C��Ag+ D��SO42�D
������п�̸ɵ����һ��һ�ε�أ����Ϊ����п���м���̼��������Χ��̼�ۡ�MnO2��ZnCl2��NH4Cl����ɵĺ�״�����õ���ڷŵ���̲���MnOOH�����մ����÷ϵ�ؿɵõ����ֻ���ԭ�ϡ��ش��������⣺
(1)�õ�ص�������ӦʽΪ ________________________����ط�Ӧ�����ӷ���ʽΪ________________________________________
(2)�ϵ�غ�״������ˮ�������ˣ���Һ����Ҫ��ZnCl2��NH4Cl�����߿�ͨ�� ___________________________________ ������ա�
(3)��������Ҫ�ɷ���MnO2��̼�ۺ�MnOOH�������еõ��ϴ���MnO2������ķ�����_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
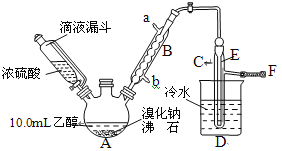
����Ŀ��ʵ�����û�������ˮ�ķ����ϳɻ���ϩ����ʵ���װ����ͼ��ʾ��
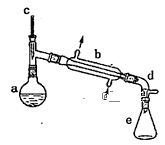
�����õ����й��������£�
��Է������� | �ܶ�/(g��cm-3) | �е�/�� | �ܽ��� | |
���Ѵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
������ʵ�鲽��ش����⣺
����ϳ�
��a�м���10.0g��������2Ƭ���Ƭ����ȴ��������������1mLŨ���ᣬb��ͨ����ȴˮ��ʼ��������a�������������¶Ƚӽ�90�档
��l�����Ƭ��������__��
��2��a�з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ___����ʵ�������ײ������л�������Ľṹ��ʽΪ__��
�����ᴿ
����Ӧ�ֲ��ﵹ���Һ©���У�����������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������X�õ������Ļ���ϩ��������������Ϊ4.1g��
������������ʼ���
��3���ٺ˴Ź��������������������Ƿ�Ϊ����ϩ������ϩ��������___�ֲ�ͬ��ѧ��������ԭ�ӡ�
�ڱ�ʵ�����û���ϩ�IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ���ʵ�����M(g)��N(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�ӦM(g)+N(g)![]() P(g)+Q(g)���õ������������ݣ�
P(g)+Q(g)���õ������������ݣ�

����˵����ȷ���ǣ� ��
A.��ʵ��2�����ѹ��Ϊ1L��c(Q)Ϊ0.4molL-1
B.�¶����ߣ��÷�Ӧ��ƽ�ⳣ������
C.ѡ����ʵĴ����ɽ��÷�Ӧ�Ļ�ܣ����M��ת����
D.ʵ��1��M�Ļ�ѧ��Ӧ����Ϊ0.32molL-1min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G��һ�����Ƽ����Ժ�������Ⱦ����Чҩ�м��壬���Ʊ�·����ͼ��

(1)������C�еĺ�����������_____��
(2)A��B�ķ�Ӧ������______��
(3)������F�ķ���ʽΪC14H21NO3��д��F�Ľṹ��ʽ______��
(4)�������Ʊ�·�߿�֪����ӦB��C��Ŀ����______��
(5)ͬʱ��������������B��ͬ���칹�干��_______�֡�
�ٷ����к��б���������NaHCO3��Һ��Ӧ��
����ʹFeCl3��Һ����ɫ
(6)��������֪ʶ����������Ϣ�������![]() ��CH3NO2Ϊԭ���Ʊ�
��CH3NO2Ϊԭ���Ʊ� �ĺϳ�·��ͼ____(���Լ����ã��ϳ�·������ͼʾ�����������)��
�ĺϳ�·��ͼ____(���Լ����ã��ϳ�·������ͼʾ�����������)��
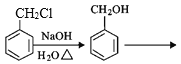
 �����еڶ�����Ӧ�ķ���ʽΪ_____��
�����еڶ�����Ӧ�ķ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ��H
2CO2(g)+S(l) ��H
��1����֪��2CO(g)+O2(g)=2CO2(g) ��H1=-566kJmol-1��S(l)+O2(g)=SO2(g) ��H2=-296 kJmol-1����Ӧ����H=___kJmol-1��
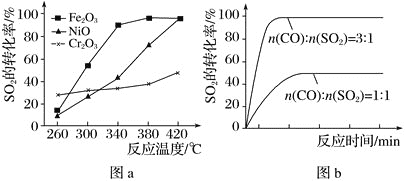
��2������������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼa��ʾ��260��ʱ___(����Fe2O3������NiO������Cr2O3��)��������Ӧ������졣Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ������Ǽ۸����أ�ѡ��Fe2O3����Ҫ�ŵ���___��
��3������С����380�桢Fe2O3������ʱ���о��˲�ͬͶ�ϱ�[n(CO)��n(SO2)]��SO2ת���ʵ�Ӱ�죬�����ͼb��ʾ���������n(CO)��n(SO2)=1��1ʱ��SO2ת���ʽӽ�50%��ԭ��___��
��4����ҵ�ϻ�����Na2SO3��Һ���������е�SO2��Na2SO3+SO2+H2O=2NaHSO3��ij�¶�����1.0molL-1Na2SO3��Һ���մ�����SO2������Һ��c(SO32-)����0.2molL-1ʱ���������������½���Ӧ�������ռ�����ʱ��Һ��c(HSO3-)ԼΪ___molL-1����Һ��pH=___��(��֪���¶����������ƽ�ⳣ��Ka1=1.75��10-2��Ka2=1.25��10-7)
��5����Na2SO3��Һ�������Ṥҵβ���еĶ����������õĻ��Һ���е��ѭ�������������¹��ս�����ѭ�������������������ӽ���Ĥ���ѭ������������ͼ��ʾ����д���õ������У�������������Ӧ�ķ���ʽ��___��
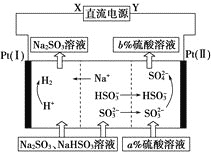
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ������飬�䷴Ӧԭ����ʵ���װ�����£���Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã���
H3PO4��Ũ��+NaBr![]() NaH2PO4+HBr��CH3CH2OH+HBr
NaH2PO4+HBr��CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
�й����ݼ��±���
�Ҵ� | ������ | �� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ���ɫҺ�� |
�ܶ�g/mL | 0.79 | 1.44 | 3.1 |
�е�/�� | 78.5 | 38.4 | 59 |
��1��A�з����ʯ��������___��
��2������B������Ϊ___��B�н�ˮ��Ϊ___���a����b�����ڡ�
��3��ʵ�����õ�Һ©�������Һ©�����ŵ�Ϊ��___��
��4����ȡ������ʱ��Ϊʲô������ŨH2SO4����Ũ���___���û�ѧ����ʽ��ʾ����
��5����C�е����Һת��������ƿ�У�������ε���ŨH2SO4�Գ�ȥˮ�����ʣ��μ�Ũ����Լ1��2mL��ʹ��Һ���Էֲ㣬���÷�Һ©����ȥ����㣬�������ᴦ�����������ת������ƿ��ˮԡ���������ռ���35��40�����Լ10.0g�����Ҵ��ĽǶȿ��ǣ���ʵ������������IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ֽ��Ȼ�淋Ĵ��������ϩ�����������£�
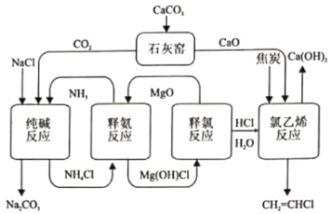
��1�����Ͱ���Ӧ��������ܷ����Ļ�ѧ��Ӧ��
NH4Cl(s)�P NH3(g)+HCl(g) ��H=163.57 kJ/mol
MgO(s)+ HCl(g) �P MgOHCl(s) ��H=-102.23 kJ/mol
���ܷ�ӦNH4Cl(s)+MgO(s)�PNH3(g)+MgOHCl(s) ��H=____kJ/mol
��2�������ȷ�Ӧ�����ܵĻ�ѧ��Ӧ�У�
i. MgOHCl(s)�PMgO(s)+ HCl(g) ��H=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)�PMgCl2(s)+H2O(g) ��H=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ��H=+94.61 kJ/mol
ͼΪ�����ȷ�Ӧ���ڲ�ͬ�¶��¸���ֵ�ƽ����ɣ��ش���������
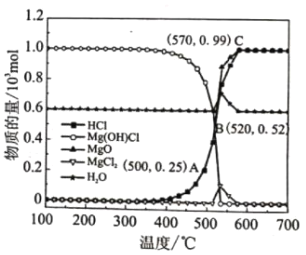
��Ӧѡ�����ѷ�Ӧ�¶���___________
��500��Cʱ�����ȷ�Ӧ����ѹǿΪP��������¶��·�Ӧi��ƽ�ⳣ��Kp=___________ (KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��)
�۽��ƽ���ƶ�ԭ����ԭ��������ˮ������Ŀ����___________
��3��������ϩ��Ӧ���У�![]() (g)+HCl(g)
(g)+HCl(g)![]() CH2=CHCl(g)�ķ�Ӧ������ͼ�����������ڴ��������������*��ע
CH2=CHCl(g)�ķ�Ӧ������ͼ�����������ڴ��������������*��ע
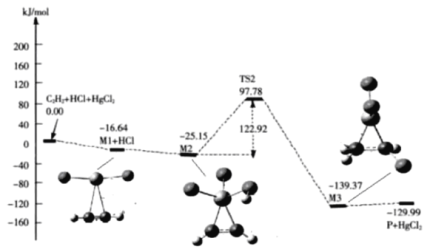
��̼̼�����ļ��ܣ�M1_____ ![]() (����>������<��)
(����>������<��)
����M2��M3���Ļ�ѧ����ʽΪ__________
�۸÷�Ӧ�ľ��ٲ���Ϊ__________
��4�������йظù��յ�˵������ȷ����______(����)
A����ѭ�����õ�������NH3��MgO��HCl
B����ʯ��Ҥ���������Ӧ���ĸ������ʵ����Դ������
C������MgO��Ϊ����������Чʵ��NH3��HCl����
D�������˴��ȼҵ�IJ�Ʒ��ȡHCl�ĵ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com