
����Ŀ��ij����С���������ͼ��ʾ��ʵ��װ�ã�ͼ�й̶�װ������ȥ��������SO2���ʵ��о���
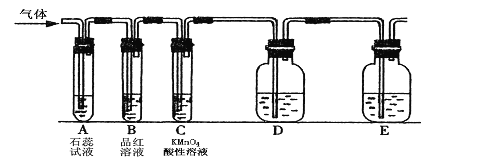
��1�������ʷ���ĽǶȣ�SO2����________������ԡ����ԡ��������д�������������γɵķ�Ӧ����ʽ�� _______ ��_____ ��
��2��ͼ��Dװ�ÿ�������֤SO2���и����ʣ�������������Լ��� _____��
��3�������װ��ͨ��SO2ʱ��A����ɫʯ����Һ��죬�û�ѧ���������ԭ���� ______ ��
��4����Ԫ�ػ��ϼ۵ĽǶȷ�����SO2�����ʡ�
�ٵ����װ��ͨ��SO2һ��ʱ��ɹ۲�C����Һ��ɫ��MnO4-ת��ΪMn2+,˵��SO2��
��______�ԣ���Ӧ�����ӷ���ʽΪ _________��
������֤SO2��������һ��������ʣ���ѡ���ҩƷ��__________��
A���������� B��Ũ���� C����ˮ D��������Һ
���𰸡� ���� SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 �μӷ�̪��NaOHϡ��Һ SO2+H2O=H2SO3 ��ԭ 5SO2 + 2MnO4 -+ 2H2O = 5SO4 2-+ 2Mn2+ + 4H + D
��������SO2����������������������������ͨ�ԣ�����SO2�����������ԡ���ԭ�Ժ�Ư���ԣ��ݴ˷������
��1����������ͼӦֻ�����κ�ˮ������Ϊ������������������ˮ��Ӧ���������ᣬ�������ױ�����Ϊ����Ӷ��γ����꣬��Ӧ�ķ���ʽΪSO2+H2O��H2SO3��2H2SO3+O2��2H2SO4����2��Ҫ��֤�������������������������ͼӦ�����������ƣ�����������������Ʒ�Ӧ�����������ƣ�����������Һ������������Һ������ɫ��Һ�����Է�Ӧ�������ԣ���������Һ�м����̪��Һ�����������Ƶ����ɣ���D��ʢ�ŵ�Һ���ǵμӷ�̪����������ϡ��Һ����3�����������ˮ��Ӧ���������ᣬ�������ܵ���������Ӷ�ʹ����Һ�����ԣ���ɫʯ����Һ������ɫ��������ɫʯ����Һ���ɫ���䷴Ӧ����ʽΪSO2+H2O��H2SO3����4�������Ը�����ؾ���ǿ�����ԣ����������������������ᣬ�÷�Ӧ�ж�����������ԭ�������Զ���������л�ԭ�ԣ���Ӧ����ʽΪ 5SO2 + 2MnO4 -+ 2H2O��5SO4 2-+ 2Mn2+ + 4H+����Ҫ֤����������������ԣ������������ͻ�ԭ�����ʷ���������ԭ��Ӧ��A������������������ԣ���������������A����B��Ũ�������ǿ�����ԣ��ҺͶ�������Ӧ��B����C����ˮ����ǿ�����ԣ���������������C����D�����ƾ��л�ԭ�ԣ��ܱ���������������D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�����У��������Ӽ����ƻ����й��ۼ����ƻ����ǣ� ��
A.�� SO2 ͨ��ˮ��
B.�� HCl ͨ��ˮ��
C.�ռ�����ˮ
D.�����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ʵ�鱨�����г������������к�������
A����10mL��Ͳ��ȡ7.13 mLϡ����
B����������ƽ����25.20 g NaCl
C���ù㷺pH��ֽ���ij��Һ��pHΪ2.3
D����25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ21.70 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д��ȷ����
A��NaHSO4=Na++H++SO42- B��NaHCO3=Na++H++CO32-
C��CH3COOH=CH3COO-+H+ D��H2CO32H++CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ѧС������ݰ�����ԭ����ͭ��Ӧ��ԭ���ⶨijͭ����Ʒ������CuO��δ���н���ͭ�ĺ�����
(1)��С��������ͼװ��(�����ظ�ѡ�ã���ͨ���ⶨ��Ӧ����ˮ���������ﵽʵ��Ŀ�ġ�
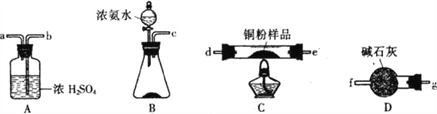
���������������Ӹ������ӿڣ�˳��Ϊ______________(��Сд��ĸ��ţ���
��װ��B�й����Լ�������Ϊ____________________��
��װ��A������Ϊ____________��
��������������Ӧ���Ƚ��е���___________(����ţ���i.���ȷ�Ӧ�� ii.����ƿ����εμ�Ũ��ˮ��ԭ��Ϊ________________________��
(2)��С����������װ��ͨ���ⶨ��Ӧǰ��װ��C�й���������仯���ﵽʵ��Ŀ�ġ�
���������������Ӹ�װ�ã�˳��Ϊ______________(���д��ĸ��ţ���
����ȡm1 gͭ����Ʒ����÷�Ӧǰװ��C������Ϊm2 g,��ַ�Ӧ��װ��C������Ϊm3g��д����Ʒ�н���ͭ��������������ʽ__________________��
(3)��ϡ���ᡢŨ���ᡢ����ˮ��˫��ˮ��ѡ�ú��ʵ��Լ����������һ���ⶨ��Ʒ�н���ͭ������ʵ�鷽��(д����Ҫ���裬���������������̵�ϸ��)_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��Na2S2O3+H2SO4=Na2SO4+SO2+S��+H2O�����и���ʵ�������ȳ��ֻ��ǵ� �� ��
ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
V/mL | c/��molL��1�� | V/mL | c/��molL��1�� | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��˷����ۼ����ǣ� ��
A.�ɱ����ȱ�ɶ�����̼����
B.���ʯ�ۻ�
C.��������ˮ
D.ʳ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬������A�����磬���ۻ�������ˮ������ȫ���롣���й�������A��˵���У��D����ȷ����
A���ǵ���� B��������� C�����ӻ����� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3![]() NH4����NH2��.�ݴ��жϣ����������������
NH4����NH2��.�ݴ��жϣ����������������
A��һ���¶���Һ����c(NH4��)��c(NH2��)��һ������
B��Һ���к���NH3��NH4����NH2��������
C��ֻҪ�������������ʣ�Һ����c(NH4��)��c(NH2��)
D��Һ���ﵽ����ƽ��ʱc(NH3)��c(NH4��)��c(NH2��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com