
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答: 
(1)a点之前的反应的离子方程式为 .
(2)a点到b点之间的反应的离子方程式是、 .
(3)c点二氧化碳体积是L.
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为 .
【答案】
(1)Ba2++CO2+2OH﹣═BaCO3↓+H2O
(2)2OH﹣+CO2═CO32﹣+H2O;CO32﹣+H2O+CO2═2HCO3﹣
(3)15
(4)1:1
【解析】解:向NaOH和Ba(OH)2的混合稀溶液中通入CO2 , 开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3 , b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2 . (1)由上述分析可知,a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,离子方程式为:Ba2++CO2+2OH﹣═BaCO3↓+H2O,所以答案是:Ba2++CO2+2OH﹣═BaCO3↓+H2O;(2)a~b之间的反应:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3 , 离子方程式为:2OH﹣+CO2═CO32﹣+H2O;CO32﹣+H2O+CO2═2HCO3﹣ , 所以答案是:2OH﹣+CO2═CO32﹣+H2O;CO32﹣+H2O+CO2═2HCO3﹣(3)由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知c点二氧化碳的体积为10L+5L=15L,所以答案是:15;(4)氢氧化钡、氢氧化钠消耗二氧化碳体积分别为5L、5L,结合方程式可知,溶液中Ba(OH)2和NaOH的浓度之比为1:1,所以答案是:1:1.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 蔗糖和麦芽糖均为双糖
B. 油脂的水解反应称为皂化反应
C. 植物油能使酸性高锰酸钾溶液褪色
D. 淀粉和纤维素水解的最终产物均为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )
A.0.12molL﹣1
B.0.1molL﹣1
C.1.2molL﹣1
D.1.0molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是 ( )
A. 元素相对原子质量依次递增 B. 元素的最高正化合价呈周期性变化
C. 元素原子最外层电子排布呈周期性变化 D. 元素金属性或非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-===Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是
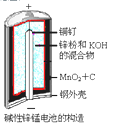
A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活、航空航天等方面应用广泛。
(1)肼(N2H4)与O2反应的能量变化如图所示。

已知,N—H键、O=O键的键能分别为391kJ/mol、497kJ/mol,则E1=_______kJ/mol,N2H4(g)中N-N键的键能为____________。
(2)某温度下,在1L恒容密闭容器中投入2mol N2H4(g)和lmolN2O4(g),发生反应:
2 N2H4(g)+ N2O4(g)=3N2(g) +4H2O (g) △H=-1097kJ/mol,该反应中 N2以平均反应速率为0.06mol/(L·min)进行10min时达到平衡状态。
①下列叙述能说明反应达到平衡状态的是________。
A.c(N2):c(H2O)=3:4 B.混合气体密度保持不变
C.混合气体平均相对分子质量保持不变 D.混合气体中N2体积分数保持不变
②平衡时,![]() 为________,混合气体总物质的量为_______。
为________,混合气体总物质的量为_______。
③甲、乙是体积相同的恒容密闭容器,起始投入N2H4(g)和N2O4(g)的量相同,甲在恒温条件下达到平衡,乙在绝热条件下达到平衡。平衡时,N2H4(g)的转化率较大的是_____(填 “甲”或“乙”)
(3)如图是反应I:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)和反应Ⅱ:N2(g)+O2(g)=2NO(g)的平衡常数的负对数(pK=-lgK)与温度T的关系。

①根据图中的数据判断,下列说法正确的是_______。
a.反应I为放热反应
b.常温下,反应I的速率很大,二而反应Ⅱ的速率很小
c.升高温度.反应I的速率减小,反应Ⅱ的速率增大
d.x K时,反应I和反应Ⅱ的反应程度相差很大
②下列叙述对反应I自发性判断正确的是_____。
A. 较高温度下能自发进行
B. 较低温度下能自发进行
C. 所有温度下均能自发进行
D. 任何温度下都不能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com