
【题目】橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如图所示,下列关于橙花醇的叙述,错误的是
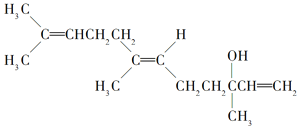
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D.1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g Br2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是
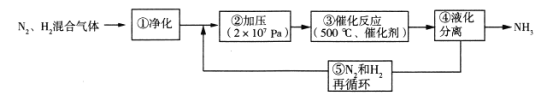
A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )

A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)最近材料科学家发现了首例带结晶水的晶体在5K下呈现超导性。该晶体的化学式为Na0.35CoO2·1.3H2O(该晶体的摩尔质量为122g·mol-1),若用NA表示阿伏加德罗常数,则12.2g该晶体中含氧原子数为___,氢原子的物质的量为___mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数___(填“大于”“等于”或“小于”)0.2NA。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=___mol/L(用以上字母表示,且必须化简)。
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式____。
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____mol/L。反应的离子方程式为____。
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
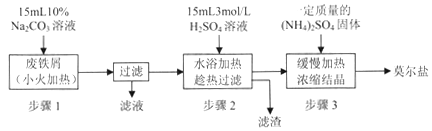
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向体积为2L的密闭容器中通入NO2 (气体)和N2O4 (无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(1)0~3min内用N2O4表示的平均反应速率为___________。
(2)若升高温度,则v(正)__________(填“加快”“减慢”或“不变”,下同),v(逆)___________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中v(NO2)=0.2mol·L-1·s-1,乙中v(N2O4)=9mol·L-1·min-1,则_________(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是(_____)
A v(NO2)=2 v(N2O4)
B 容器内压强不再发生变化
C X的体积分数不再发生变化
D 容器内气体的原子总数不再发生变化
E 相同时间内消耗n mol Y的同时生成2n mol X
F 相同时间内消耗n mol Y的同时消耗2n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与11.7g Na2O2中氧原子数相等的是( )
A.5.6g COB.4.4g CO2C.8g SO3D.9.8g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:![]() 。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是
。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是![]()
![]()
A.混合气体的压强B.混合气体的密度
C.混合气体的平均相对分子质量D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com