
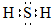 ,故答案为:氧(或O);H2O2;
,故答案为:氧(或O);H2O2;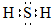 ;
;

科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2 Fe Cl2+Cl2═Fe3++4Cl- |
| B、过氧化钠与水反应 Na2O2+H2O=Na++OH-+O2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用盐酸除水垢 2H++CaCO3═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
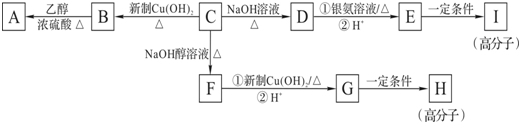
查看答案和解析>>
科目:高中化学 来源: 题型:
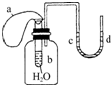 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将观察到的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将观察到的现象是( )| A、试管内水变为红色 |
| B、试管内有沉淀生成 |
| C、气球a被吹大 |
| D、U形管水位d高于c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com