
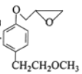
【题目】美托洛尔可治疗各型高血压及作血管扩张剂,它的一种合成路线如下:

已知:![]() +
+![]()
![]()
![]() +HCl
+HCl
(1)A的化学名称是 _________,B的结构简式为__________,美托洛尔中含氧官能团的名称是_____________。
(2)A合成B的反应中,加人K2CO3的作用可能是 _________。
(3)B合成C的反应类型是________ 。
(4)F生成G的化学方程式为________ 。
(5)氯甲基环氧乙烷(![]() ) 是合成有机化合物的重要原料,实验室检验卤代烃中氯原子的常用试剂是______。
) 是合成有机化合物的重要原料,实验室检验卤代烃中氯原子的常用试剂是______。
(6)芳香族化合物M是F的同分异构体.则符合下列条件的M共有___种(不含立体异构)。
①苯环上只有2个取代基
②1molM与足量 Na 充分反应能生成1mol H2
③能与FeCl3溶液发生显色反应。
其中核磁共振氢谱为5组峰同分异构体的结构简式为_______。
【答案】对羟基苯乙醛 ![]() 醚键、羟基 消耗反应生成的HCl,有利于反应正向进行,有利于提高的B的产率 加成反应
醚键、羟基 消耗反应生成的HCl,有利于反应正向进行,有利于提高的B的产率 加成反应 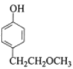 +
+![]()
![]()
 +HCl NaOH水溶液、硝酸、硝酸银溶液 15
+HCl NaOH水溶液、硝酸、硝酸银溶液 15 
【解析】
A的分子式为C8H8O2,不饱和度为5,说明除苯环外还有一个双键,A发生信息中取代反应生成B,B与A相比多了7个碳原子,说明A中只有一个酚羟基,且该过程中A的双键没有打开;B与亚硫酸氢钠发生反应生成C,根据C的结构简式可知,B到C的过程中双键打开,所以该过程应为加成反应,且根据C的结构简式可反推出中A和B中的双键应为醛基,所以A为![]() 、B为
、B为![]() 。
。
(1)根据分析可知A为![]() ,名称为对羟基苯乙醛;B的结构简式为
,名称为对羟基苯乙醛;B的结构简式为![]() ;由结构可知美托洛尔中含氧官能团为:醚键、羟基;
;由结构可知美托洛尔中含氧官能团为:醚键、羟基;
(2)A发生取代反应有HCl生成,加入K2CO3的作用可能是:消耗反应生成的HCl,有利于反应正向进行,有利于提高的B的产率;
(3)根据分析可知B到C的反应为加成反应;
(4)对比F、G的结构,可知F中羟基上H原子被![]() 替代生成G,同时生成HCl,反应方程式为:
替代生成G,同时生成HCl,反应方程式为: +
+![]()
![]()
 +HCl;
+HCl;
(5)先进行水解或消去反应使氯元素以氯离子形成进入溶液,再用硝酸酸化,最后用硝酸银溶液检验氯离子,故实验室检验氯原子所用的试剂是:NaOH水溶液、硝酸、硝酸银溶液;
(6)芳香族化合物M是F的同分异构体,且符合下列条件:③能与FeCl3溶液发生显色反应,说明含有酚羟基,②1mol M与足量Na充分反应能生成1mol H2,说明分子中有2个-OH,①苯环上只有2个取代基,其中1个为-OH,另一个为CH3CH2CH2OH或![]() 中烃基去掉1个H原子形成的基团,前者有3种、后者有2种,与酚羟基均有邻、间、对3种位置结构,故符合条件的共有:3×(3+2)=15种,其中核磁共振氢谱为5组峰同分异构体的结构简式为:
中烃基去掉1个H原子形成的基团,前者有3种、后者有2种,与酚羟基均有邻、间、对3种位置结构,故符合条件的共有:3×(3+2)=15种,其中核磁共振氢谱为5组峰同分异构体的结构简式为: 。
。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g)![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化
A. ③④B. ①②C. ③⑤D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
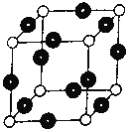
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
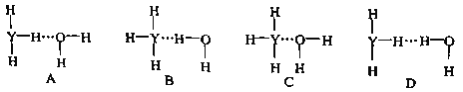
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2019年我国电动汽车的新能源,其电极材料可表示为![]() +3
+3![]() ,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
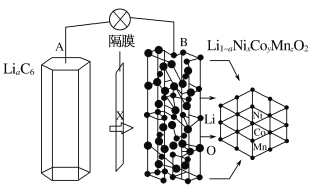
A.允许离子X通过的隔膜属于阴离子交换膜
B.充电时,A为阴极,Li+被氧化
C.可从无法充电的废旧电池的石墨电极中回收金属锂
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源在人类生活中应用广泛。回答下列问题:
(1)氢气燃烧时放出大量的热,这是由于反应物的总能量____生成物的总能量(选填“大于”“小于”或“等于”,下同),从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_____形成产物的化学键释放的总能量。
(2)H2被认为是21世纪矿物燃料的理想能源,每克氢气和汽油燃烧放出的热量分别为55kJ和46kJ。汽油可由石油经___和____获得;请分析氢气作为能源替代汽油的优势:_____;____(写两点)。
(3)在氢氧碱性燃料电池中,负极发生反应的电极反应式:___,正极的电极反应式为____。若反应后得到5.4g液态水,此时氢氧燃料电池转移的电子数为____。
(4)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

片刻后可观察到的现象是(指悬吊的金属圈)____。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(5)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____。
②若将①中的反应设计成原电池,写出负极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
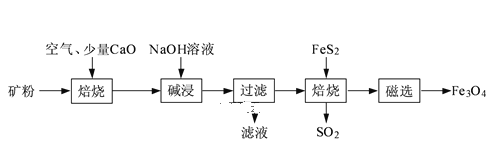
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为____。
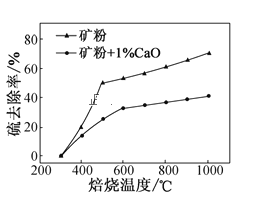
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于____。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由___(填化学式)转化为____(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O=FeCl3·6H2O。
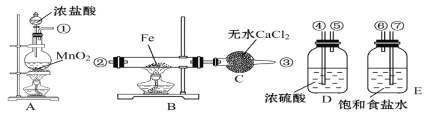
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):①接___,___接___,___接___。
(2)烧瓶A中氧化剂是______(填物质名称),发生反应的离子方程式_______________________, B中反应的化学方程式_________________________________。
(3)容器D的作用是_______________________,容器E的作用是_________________
(4)A、B中的酒精灯应先点燃_____处(填“A”或“B”)的酒精灯,理由是____________________
(5)这套实验装置是否完整?_____(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com