

| A、原子半径的大小为:Z>Y>X |
| B、气态氢化物的还原性:Z<Y |
| C、若Y可作半导体材料,则X、Z的单质常温下均为气体 |
| D、若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
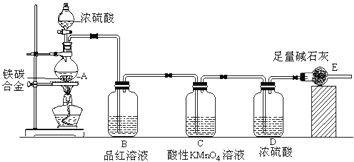
查看答案和解析>>
科目:高中化学 来源: 题型:
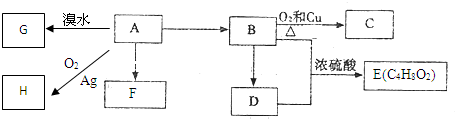
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、立方烷、棱晶烷和盆烯都不能使溴水褪色 |
| B、棱晶烷和盆烯互为同分异构体 |
| C、立方烷的二氯代物共有3种 |
| D、立方烷、棱晶烷中C原子都形成4个单键,因此它们都属于烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逸出气体若用碱石灰吸收,增重b克.则测定混合物中Na2CO3的质量分数偏小 |
| B、把所得溶液加热蒸干,并灼烧至恒重,得b克固体.蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D、产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
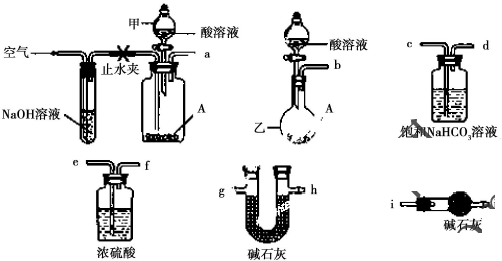
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、Cl2O |
| C、ClO2 |
| D、Cl2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com