
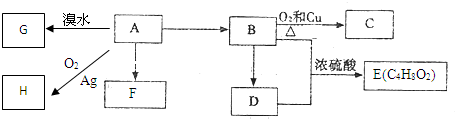
 ,乙烯在Ag作催化剂条件下氧化生成H为
,乙烯在Ag作催化剂条件下氧化生成H为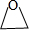 ,据此解答.
,据此解答. ,乙烯在Ag作催化剂条件下氧化生成H为
,乙烯在Ag作催化剂条件下氧化生成H为 ,
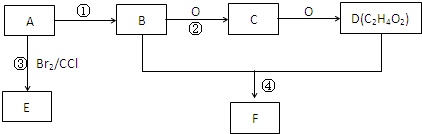
,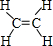 ,D为乙酸,官能团的名称是:羧基,G的名称是 1,2-二溴乙烷,F为聚乙烯,链节是-CH2-CH2-,
,D为乙酸,官能团的名称是:羧基,G的名称是 1,2-二溴乙烷,F为聚乙烯,链节是-CH2-CH2-, ;羧基;1,2-二溴乙烷;-CH2-CH2-;
;羧基;1,2-二溴乙烷;-CH2-CH2-;| Ag |
 ,
,| Cu |
| △ |
| Ag |
 ;2CH3CH2OH+O2
;2CH3CH2OH+O2| Cu |
| △ |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol?L-1 |
| B、2.0 mol?L-1 |
| C、1.5.mol?L-1 |
| D、1.0 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
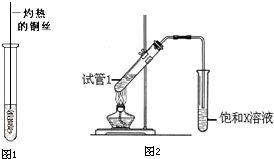
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D元素处于元素周期表中第3周期第Ⅳ族 |
| B、B与D形成的化合物中,每个原子的最外层电子均为8个电子 |
| C、B、D的最高价氧化物中,D的最高价氧化物熔沸点高的根本原因在于D的最高价氧化物相对分子质量比B的最高价氧化物高 |
| D、A与D形成的化合物是一种稳定性较差的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径的大小为:Z>Y>X |
| B、气态氢化物的还原性:Z<Y |
| C、若Y可作半导体材料,则X、Z的单质常温下均为气体 |
| D、若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关性质 |
| T | T的单质能与冷水剧烈反应,所得的强碱性溶液中含有两种 电子数相等的阴、阳离子 |
| X | X原子的最外层电子数是其最内层电子数的3倍 |
| Y | 在第3周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com