
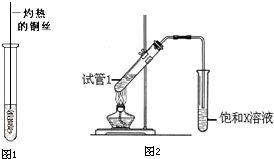
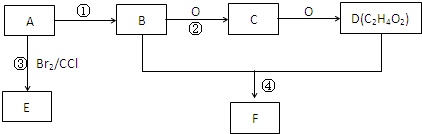
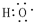 ;D为CH3COOH,含有羧基,
;D为CH3COOH,含有羧基,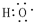 ;羧基;
;羧基;| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、第四周期ⅡB族;s区 |
| B、第四周期ⅧB族;d区 |
| C、第四周期Ⅷ族;d区 |
| D、第四周期Ⅷ族;ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol?L-1?min-1 |
| B、2.5 mol?L-1?min-1 |
| C、2 mol?L-1?min-1 |
| D、5 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
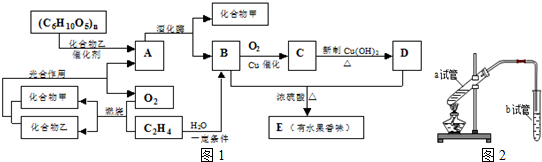
查看答案和解析>>
科目:高中化学 来源: 题型:
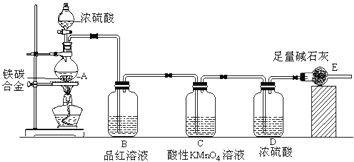
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、位于元素周期表中短周期 |
| B、原子最外层有1个电子 |
| C、属于金属元素,和Na同属于ⅠA族 |
| D、能和水反应,生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
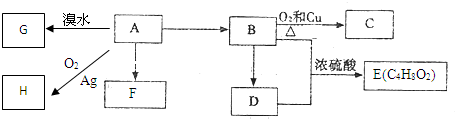
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逸出气体若用碱石灰吸收,增重b克.则测定混合物中Na2CO3的质量分数偏小 |
| B、把所得溶液加热蒸干,并灼烧至恒重,得b克固体.蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D、产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com