
【题目】某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4–+ ____ H2C2O4+ ____ H+ ![]() ____ Mn2++ ____CO2↑ + ____ H2O
____ Mn2++ ____CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
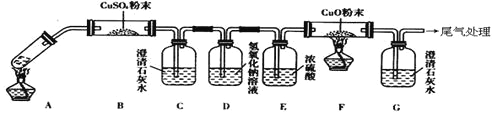
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末由黑色变为红色。据此回答:
上述装置中,D的作用是__________________.乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________(用文字简单表述)。
(5)以上溶液中各离子的浓度由大到小的顺序为_________(用离子符号表示)。
【答案】HCO3-+H2C2O4=HC2O4-+CO2↑+H2O 还原性 2 5 6 2 10 8 除去混合气体中的CO2 H2C2O4![]() H2O+CO↑+CO2↑ 反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性 c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
H2O+CO↑+CO2↑ 反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性 c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
【解析】
(1)因为草酸的酸性比碳酸强,反应会生成CO2和水,因“足量的草酸”,故还生成NaHC2O4。
(2)溶液的紫红色褪去说明KMnO4被还原,草酸具有还原性。根据化合价升降守恒和电荷守恒配平。
(3)根据题给装置和实验现象可知,本实验的目的是加热草酸使其分解,然后依次检验草酸分解的产物。B管中“CuSO4粉末变蓝”说明分解产物中有水蒸气,C瓶中澄清石灰水变浑浊说明草酸分解产生CO2,D瓶NaOH溶液的作用是吸收过量的CO2,E瓶浓硫酸吸收气流中的水蒸气,F中CuO粉末由黑色变为红色,说明CuO被还原为Cu,从草酸组成元素看还原性气体只可能是CO,CO被氧化为CO2,所以G瓶中澄清石灰水变浑浊,根据产物即可写出草酸分解的化学方程式。
(4)因为草酸是二元酸,与NaOH中和反应的产物因酸、碱物质的量之比不同产物不同:H2C2O4+2NaOH=Na2C2O4+2H2O或H2C2O4+NaOH=NaHC2O4+H2O,根据产物的性质分析溶液显酸性的原因。
(5)根据(4)溶液中溶质的电离和水解反应的相对强弱分析各离子浓度的大小关系。
(1)因乙二酸属于二元中强酸,酸性强于碳酸,根据强酸制弱酸的原理,NaHCO3与H2C2O4反应有CO2和水生成,又因乙二酸足量,故生成酸式盐NaHC2O4,其离子方程式为:H2C2O4+HCO3-=HC2O4-+CO2↑+H2O。
(2)KMnO4溶液显紫红色,因为“溶液的紫红色褪去”说明KMnO4被还原,所以草酸具有还原性。锰元素由MnO4-中的+7价降到Mn2+中的+2价,每个Mn降低5价,碳元素由H2C2O4中的+3价升高到CO2中的+4价,每个H2C2O4升高2价,根据化合价升高的总价数=化合价降低的总价数,MnO4-和Mn2+计量数均为2,H2C2O4的计量数为5,CO2计量数为10,再根据电荷守恒可知H+的计量数为6,最后根据氢元素守恒可知H2O的计量数为8。配平了的离子方程式为:2MnO4-+5H2C2O4+6H+![]() 2Mn2++10CO2↑+8H2O。
2Mn2++10CO2↑+8H2O。
(3)根据题给装置和实验现象可知,本实验的目的是加热草酸使其分解,然后依次检验草酸分解的产物。B管中“CuSO4粉末变蓝”说明乙二酸分解产生了水蒸气,C瓶中“澄清石灰水变浑浊”说明草酸分解产生了CO2,D瓶NaOH溶液的作用是吸收混合气体中过量的CO2,E瓶浓硫酸吸收气体中的水蒸气,根据“F中CuO粉末由黑色变为红色”,可推知黑色的CuO被还原为紫红色的Cu,CuO被还原,说明分解产物中有还原性气体,从草酸组成元素看还原性气体只可能是CO,CuO将CO氧化为CO2,CO2使G瓶中澄清石灰水变浑浊,据此可知乙二酸分解的化学方程式为:H2C2O4![]() CO2↑+CO↑+H2O。
CO2↑+CO↑+H2O。
(4)草酸晶体(H2C2O4·2H2O)的摩尔质量为126g/mol,2.52g草酸晶体的物质的量=![]() =0.02mol,100mL0.2 mol/L的NaOH溶液中NaOH的物质的量=0.1L×0.2mol/L=0.02mol,n(H2C2O4):n(NaOH)=1:1,发生的反应是H2C2O4+NaOH=NaHC2O4+H2O充分反应后所得溶液是NaHC2O4溶液,HC2O4-既能电离HC2O4-
=0.02mol,100mL0.2 mol/L的NaOH溶液中NaOH的物质的量=0.1L×0.2mol/L=0.02mol,n(H2C2O4):n(NaOH)=1:1,发生的反应是H2C2O4+NaOH=NaHC2O4+H2O充分反应后所得溶液是NaHC2O4溶液,HC2O4-既能电离HC2O4-![]() H++C2O42-,又能水解HC2O4-+H2O
H++C2O42-,又能水解HC2O4-+H2O![]() H2C2O4+OH-,既然溶液显酸性,则可推知:HC2O4-电离程度大于其水解程度,导致溶液中c(H+)>c(OH-),所以溶液显酸性。
H2C2O4+OH-,既然溶液显酸性,则可推知:HC2O4-电离程度大于其水解程度,导致溶液中c(H+)>c(OH-),所以溶液显酸性。
(5) 由(4)可知NaHC2O4溶液中HC2O4-电离程度大于其水解程度,且电离和水解都是微弱的,溶液中c(H+)>c(OH-),所以溶液中各离子的浓度由大到小的顺序是:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 。


科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
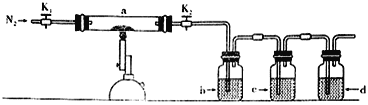
A. 分解的气体产物中有SO3、SO2,应该先检验SO3
B. 装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C. 装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D. 装置d中的试剂为石灰水,是尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:
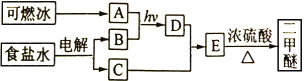
(1)B为黄绿色气体,其化学名称为____________。
(2)由A和B生成D的化学方程式为__________________。
(3)E的结构简式为____________。
(4)由E生成二甲醚的反应类型为______________________。
(5)二甲醚的同分异构体的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
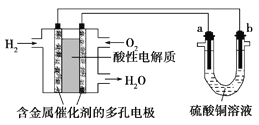
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
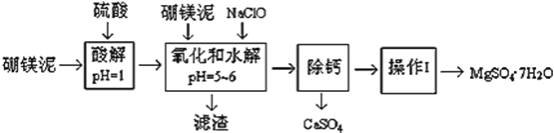
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_____________________________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活中人们常用的调味品。是下列事实中,可以证明NaCl中一定存在离子键的是
A.水溶液能导电B.易溶于水C.熔化时能导电D.有较高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为__________、__________。
(2)写出A的同分异构体的结构简式:___________________。
(3)写出下列反应的化学方程式和反应类型。
反应①:________________________________________,反应类型:_____________;
反应②:________________________________________,反应类型: _____________;
反应③: ________________________________________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试管甲中的试剂名称为______________,其作用是____________________________。用化学方程式表示甲中试剂参与的化学反应:_______________________________________。
②实验结束后从混合物中分离出D的方法为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能使溴的CCl4溶液褪色的是( )
A.①②③⑤B.④⑥⑦⑧C.①④⑥⑦D.②③⑤⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com