
【题目】下列物质有如下转化关系![]() 有的生成物未列出
有的生成物未列出![]() ,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
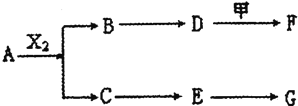
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ______ ,R、X、T的原子半径从小到大的顺序为 ______ ![]() 用元素符号表示
用元素符号表示![]() ;
;
(2)A和G等物质的量反应产物的水溶液显 ______ 性,其原因用离子方程式表示为 ______ ;
(3)A和X2反应的化学方程式为 ______ ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ______ ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为 ______ L。
【答案】第二周期VIA族 O<N<Na 酸 H2O+NH4+H++NH3H2O 4NH3+5O2 ![]() 4NO+6H2O 1:1010,或10-10或10-10:1 14
4NO+6H2O 1:1010,或10-10或10-10:1 14
【解析】
X的最外层电子数是电子层数的3倍,应为O元素,R和X相邻,且原子序数小于R,则应为N元素,Q和T同主族,Q为非金属元素,T为金属元素,在元素周期表中只有H和Na符合,则Q为H元素,T为Na元素,题中信息“D为碱,金属甲在G的浓溶液中会钝化”,说明金属甲能与碱反应,则甲为Al,结合“A、B、C、D,E均由Q,R、X、T四种短周期元素中的两种或三种组成”可知G应为HNO3,则E为NO2,C为NO,A能与氧气反应生成NO,且含有N元素,应为NH3,则B为H2O,D为NaOH,F应为NaAlO2。
(1)X为氧元素,在周期表中的位置是:第二周期,ⅥA族,R为N,X为O,T为Na,原子半径从小到大的顺序为:O<N<Na;
(2)NH3和G(HNO3)等物质的量反应生成的产物为硝酸铵,为强酸弱碱盐,铵根离子水溶液水解呈酸性,水解方程式为H2O+NH4+H++NH3H2O;
(3)A(NH3)和X2(O2)反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(4)pH均为12的NaOH溶液和NaAlO2溶液中,水电离出的c(OH-)之比为10-12:10-2=1:1010,或10-10或10-10:1;
![]() 安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2 NO2+4CO=N2+4CO2,反应中N元素化合价由+4价降低到0价,C元素化合价由+2价升高到+4价,当反应转移1mol电子时,生成0.125mol N2和0.5mol CO2,体积为0.625mol×22.4L/mol=14L。
安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2 NO2+4CO=N2+4CO2,反应中N元素化合价由+4价降低到0价,C元素化合价由+2价升高到+4价,当反应转移1mol电子时,生成0.125mol N2和0.5mol CO2,体积为0.625mol×22.4L/mol=14L。


科目:高中化学 来源: 题型:
【题目】下列描述正确的是 ( )
①CS2为V形的极性分子 ②![]() 的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和![]() 的中心原子均采用sp3杂化
的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )
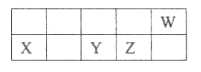
A. 原子半径由大到小的顺序:X、Y、Z、W
B. 元素最高正价由低到高的顺序:X、Y、Z、W
C. 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D. 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(可以看作铁和碳两种单质的混合物),化某学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
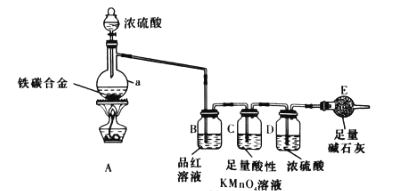
请回答下列问题:
(1)仪器 a 的名称是________________。
(2)连接好装置后,首先应进行的操作是 _____________
(3)向仪器a中滴加足量的浓硫酸,未点燃酒精灯前,A、B、C三装置中均无明显现象,其原因是___________、_______________ 。
(4)仪器a中铁与浓硫酸发生反应的化学方程式是____________ 。
(5)装置C中发生的反应中,SO2体现_________性。
(6)实验开始前,甲同学称量装置 E 的质量,并将m g铁碳合金样品放入仪器 a 中,再加入足量的浓硫酸,待仪器a中不再逸出气体时,停止加热,拆下装置E并称重,装置E增重n g。据此甲同学计算铁碳合金中铁的质量分数为________________(写表达式)。
(7)乙同学认为,依据此实验测得的数据,计算得到的铁碳合金中铁的质量分数可能会偏低,原因是空气中的CO2、H2O进入装置E中使n增大。你认为改进的方法是_____________。
(8)丙同学认为 ,即使乙同学认为的偏差得到改进 ,依据此实验测得的铁碳合金中铁的质量分数也可能仍会有误差。 你认为其中的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z 是原子序数依次增大的六种常见元素。Y 的单质在 W2 中 燃烧的产物可使品红溶液褪色 。 Z 和 W元素形成的化合物 Z3W4 具有磁性 。 U 的单质在 W2中燃烧可生成 UW 和 UW2 两种气体 。 X 的单质是一种金属,与冷水反应缓慢、与沸水反应迅速。
请回答下列问题:
(l)V的单质的分子式为____________ 。
(2)Z元素在周期表中的位置是____________。
(3)U、V、W形成的10电子氢化物中,沸点最高的是_________(填化学式,下同);V、W 的简单氢化物分子结合H+能力较强的是_________。
(4)X和Y元素形成的化合物的电子式为___________。
(5)Y的最高价氧化物对应的水化物与X单质反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
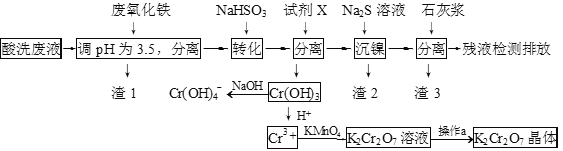
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
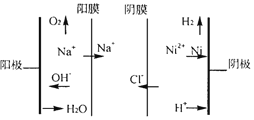
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.常温下,1L pH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移电子数目为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是
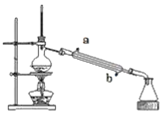
A.蒸馏烧瓶中加入碎瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出.
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 molD.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com