
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气。(实验记录的体积为累计值,已换算成标准状况):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___,原因是___。
(2)哪一段时段的反应速率最小___,原因是___。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液D.Na2CO3溶液
你认为可行的是(填编号)___。
【答案】2~3min 锌与盐酸反应放热,溶液温度升高,反应速率加快 4~5min 随着盐酸(或H+)消耗,浓度降低,反应速率下降 0.1mol/(L·min) A、B
【解析】
根据影响化学反应速率的因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2 min~3 min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降;根据v=![]() 计算反应速率;根据影响化学反应速率的因素以及氢气的量取决于H+的物质的量。
计算反应速率;根据影响化学反应速率的因素以及氢气的量取决于H+的物质的量。
(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,故答案为:2 min~3 min;
锌与盐酸反应,溶液温度升高,反应速率加快;
(2)4 min~5 min收集的氢气最少,是由于虽然反应中放热,但主要原因是c(H+)下降,反应物浓度越低,反应速率越小,故答案为:4 min~5 min;随着盐酸(或H+)消耗,浓度降低,反应速率下降;
(3)在2~3min时间段内,n(H2)=![]() =0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)=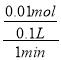 =0.1mol/(L·min),故答案为:0.1mol/(L·min);
=0.1mol/(L·min),故答案为:0.1mol/(L·min);
(4) A、加入蒸馏水,溶液的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,故A正确;
B、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,故B正确;
C、加入NaNO3溶液,减小盐酸的浓度,但此时溶液中含有硝酸,与金属反应得不到氢气,故C错误;
D、加入Na2CO3溶液,Na2CO3能与盐酸反应,盐酸的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,故D错误;故答案为:A、B。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】![]() 是一种高效安全消毒剂,常温下
是一种高效安全消毒剂,常温下![]() 为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备
为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备![]() 水溶液并检验其性质。
水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。

在圆底烧瓶中先放入![]() 固体和
固体和![]() ,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
(1)装置A用水浴加热的优点是_________;装置A中水浴温度不低于60℃,其原因是_______________。
(2)装置A中反应生成![]() 及
及![]() 等产物的化学方程式为_____________________;
等产物的化学方程式为_____________________;
(3)装置B的水中需放入冰块的目的是__________________;已知![]() 缓慢水解生成的含氯化合物只有
缓慢水解生成的含氯化合物只有![]() 和
和![]() ,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的
,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的![]() 溶液吸收尾气中的
溶液吸收尾气中的![]() ,生成物质的量之比为的1:1的两种盐,一种为
,生成物质的量之比为的1:1的两种盐,一种为![]() ,另一种为_________________。
,另一种为_________________。
Ⅱ.![]() 的含量测定
的含量测定
步骤1:量取![]() 溶液
溶液![]() ,稀释成
,稀释成![]() 试样;量取
试样;量取![]() 试样加入到锥形瓶中;
试样加入到锥形瓶中;
步骤2:调节试样的![]() ,加入足量的
,加入足量的![]() 晶体,振荡后,静置片刻;
晶体,振荡后,静置片刻;
步骤3:加入指示剂,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。
。
(4)已知:![]() ,
,![]() ,原
,原![]() 溶液的浓度为_____
溶液的浓度为_____![]() (用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
(用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
Ⅲ.设计实验验证![]() 的氧化性
的氧化性
(5)取适量![]() 水溶液加入
水溶液加入![]() 溶液中,振荡,得无色溶液。欲检验
溶液中,振荡,得无色溶液。欲检验![]() 的氧化产物,还需要用到的试剂是____________。
的氧化产物,还需要用到的试剂是____________。
(6)证明![]() 的氧化性比
的氧化性比![]() 强的方案是__________________________________。
强的方案是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是

A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧热的热化学方程式:_____________________________________________________
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ/mol;2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )

A. X极是电源负极,Y极是电源正极
B. a极的电极反应是2Cl--2e-=Cl2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除![]() 外,含有
外,含有![]() 、
、![]() 、
、![]() 等)中回收碘,实验过程如下:
等)中回收碘,实验过程如下:

(1)向含碘废液中加入稍过量的![]() 溶液,将废液中的
溶液,将废液中的![]() 还原为
还原为![]() ,其离子方程式为__________;该操作将
,其离子方程式为__________;该操作将![]() 还原为
还原为![]() 的目的是___________________。
的目的是___________________。
(2)操作![]() 的名称为__________。
的名称为__________。
(3)氧化时,在三颈瓶中将含![]() 的水溶液用盐酸调至
的水溶液用盐酸调至![]() 约为2,缓慢通入
约为2,缓慢通入![]() ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a、b的名称分别为:a__________、b__________;仪器b中盛放的溶液为__________。
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a、b的名称分别为:a__________、b__________;仪器b中盛放的溶液为__________。

(4)已知:![]() ;某含碘废水(
;某含碘废水(![]() 约为8)中一定存在
约为8)中一定存在![]() ,可能存在
,可能存在![]() 、
、![]() 中的一种或两种。请补充完整检验含碘废水中是否含有
中的一种或两种。请补充完整检验含碘废水中是否含有![]() 、
、![]() 的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、
的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、![]() 溶液、
溶液、![]() 溶液)。
溶液)。
①取适量含碘废水用![]() 多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②__________________;
③另从水层中取少量溶液,加入![]() 淀粉溶液,加盐酸酸化后,滴加
淀粉溶液,加盐酸酸化后,滴加![]() 溶液,若溶液变蓝说明废水中含有
溶液,若溶液变蓝说明废水中含有![]() ;否则说明废水中不含有
;否则说明废水中不含有![]() 。
。
(5)二氧化氯(![]() ,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用
,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用![]() 氧化酸性含
氧化酸性含![]() 废液回收碘。
废液回收碘。
①完成![]() 氧化
氧化![]() 的离子方程式:
的离子方程式:![]() ClO2+
ClO2+![]() I-1+
I-1+![]() __________=
__________=![]()
![]() +
+![]() Cl-1+
Cl-1+![]() ____________________________;
____________________________;
②若处理含![]() 相同量的废液回收碘,所需
相同量的废液回收碘,所需![]() 的物质的量是
的物质的量是![]() 的______倍。
的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂①的量应________,验证MgSO4已完全转化为Mg(OH)2的方法是____________________。
(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是_______________。
(3)试剂②可以选用____________,反应的离子方程式为__________________________。
(4)无水MgCl2在熔融状态下,通电后会得到Mg和Cl2,写出该反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com