
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
| A.该溶液的pH<7 |
| B.CN-的水解程度大于HCN的电离程度 |
| C.c(CN-)+c(HCN)=0.02 mol·L-1 |
| D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+) |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列液体均处于25℃,下列有关叙述正确的是( )
| A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同 |
| B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13 |
| C.PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍 |
| D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
| A.0.1 mol·L-1氨水,溶液的pH=13 |
| B.0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D.0.1 mol·L-1醋酸与0.1 mol·L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是( )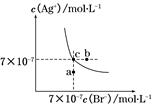
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向50 mL 0.018 mol·L-1 AgNO3溶液中加入50 mL 0.02 mol·L-1盐酸。已知AgCl(s)的溶度积常数Ksp= 1×10-10,混合后溶液的体积变化忽略不计。下列说法不正确的是( )
| A.混合后,溶液中肯定有沉淀生成 |
| B.沉淀生成后溶液中Ag+的浓度为10-5 mol·L-1 |
| C.沉淀生成后溶液的pH=2 |
| D.混合后,升高温度,溶液中Ag+的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,pH最大的是( )
| A.pH=9的氨水稀释1 000倍 |
| B.pH=9的烧碱溶液稀释1 000倍 |
| C.pH=5的盐酸稀释1 000倍 |
| D.pH=5的氯化铵溶液稀释1 000倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com