
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
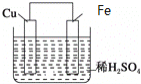
①Fe为正极,Cu为负极;②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
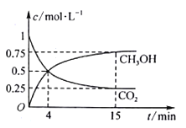
①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1LFeBr2溶液中,通入1.12L(标态下)的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是
A. 原溶液的浓度为0.1mol/L B. 反应后溶液中c(Fe3+)=0.1mol/L
C. 反应后溶液中c(Fe3+)=c(Fe2+) D. 原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请解答下列与蛋白质有关的题目:
(1)鸡蛋腐烂时,常闻到有臭鸡蛋气味的气体,该气体中主要含有___________________(填化学式),说明蛋白质中含有___________________(填元素名称)元素。
(2)误食重金属盐会中毒,这是因为___________________。
(3)浓硝酸溅在皮肤上,使皮肤呈现___________________色,这是由于浓硝酸和蛋白质发生了___________________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2=2Al23O27N5+15CO ,产物Al23O27N5中氮的化合价为______,该反应中每生成1 mol Al23O27N5,转移的电子数为________NA。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Ⅰ.Al2O3(s)+3C(s)=Al2OC(s)+2CO(g) ΔH1
Ⅱ.2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) ΔH2
Ⅲ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3
①ΔH3=_________(用ΔH1、ΔH2表示)。
②Al4C3可与足量盐酸反应制备一种烃。该反应的化学方程式为________________。
(3)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数)。
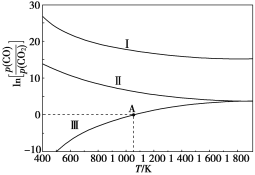
Ⅰ.Mn3C(s)+4CO2(g)![]() 3MnO(s)+5CO(g) Kp(Ⅰ)
3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g)![]() MnO(s)+CO(g) Kp(Ⅱ)
MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g)![]() 3Mn(s)+2CO(g) Kp(Ⅲ)
3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min 后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=_________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
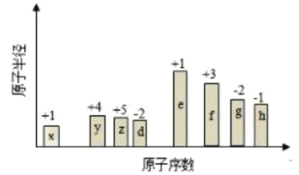
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国的新冠肺炎防疫工作已取得了阶段性胜利,疫情中心武汉市已于4月8日零时解封。在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,抗病毒治疗试用药物增加了磷酸氯喹。磷酸氯喹可由氯喹和磷酸在一定条件下制得。氯喹(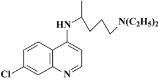 )可由以下路线合成:
)可由以下路线合成:
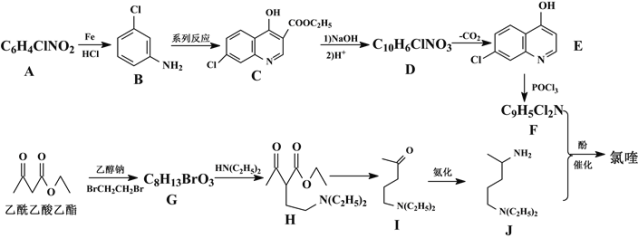
回答下列问题:
(1)A的名称为___,G中含氧官能团的名称为___,G→H的反应类型为___。
(2)写出F+J→氯喹的化学反应方程式___。
(3)有机物B与足量H2加成后的产物为X,试用“*”标出X中的手性碳原子___。
(4)M与H互为同分异构体,符合下列条件的M有___种。其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1,其结构简式为___ (任写一种)。
①含有六元环和-N(C2H5)2②酸性条件下水解产物含乙酸③能发生酯化反应
(5)参照以上合成路线,请设计以1,3-丁二烯和苯为原料合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.氯碱工业中完全电解含2 mol NaCl的溶液产生H2分子数为NA
B.14 g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C.2.0 g H218O与2.0 g D2O中所含的中子数均为NA
D.常温下,将56 g铁片投入到足量的浓硫酸中生成SO2的分子数为1. 5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com