
| 3mol×0.78g |
| 0.03L×78g |
| 0.214mol |
| 0.03L |


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水的提镁都包含化学变化 |
| B、高温条件下杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| C、纯碱可用于生产普通玻璃,也可用纯碱除去物品表面的油污 |
| D、气候环境报告中“PM2.5”就是雾霾,雾霾仅影响能见度,对人体健康没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
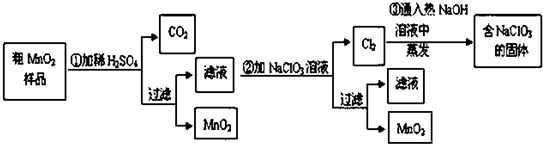
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
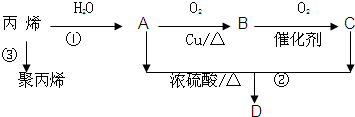
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
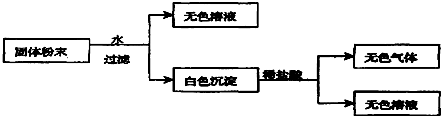
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com