
【题目】实验室制取Cl2的化学方程式为MnO2+ 4HCl![]() MnCl2+ Cl2↑+ 2H2O,当有146.0克HCl完全参加反应时,有多少摩尔氧化剂被还原?有多少摩尔还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
MnCl2+ Cl2↑+ 2H2O,当有146.0克HCl完全参加反应时,有多少摩尔氧化剂被还原?有多少摩尔还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
【答案】解:设质量为X的氧化剂被还原,生成质量为Y的还原产物,生成质量为Z 的氧化产物。
MnO2+ 4HCl![]() MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O
87 146 126 71
X 146g Y Z
![]() =
=![]() ,得X=87g;
,得X=87g;
![]() =
=![]() ,得Y=126g;
,得Y=126g;
![]() =
=![]() ,得Z=87g;
,得Z=87g;
(1)87g÷87g/mol=1mol
(2)146g÷36.5 g/mol÷2=2mol
(3)还原产物126g
(4)71g÷71g/mol×22.4L/mol=22.4L
答:1mol氧化剂被还原,有2mol还原剂被氧化,生成还原产物126g,生成的氧化产物在标准状态下体积为22.4L。
【解析】
根据氧化剂:化合价降低,得电子,被还原,生成还原产物;还原剂:化合价升高,失电子,被氧化,生成氧化产物;可知MnO2+ 4HCl![]() MnCl2+ Cl2↑+ 2H2O,二氧化锰为氧化剂,氯化锰为还原产物;HCl为还原剂,有1/2的化合价升高被氧化,生成氧化产物。
MnCl2+ Cl2↑+ 2H2O,二氧化锰为氧化剂,氯化锰为还原产物;HCl为还原剂,有1/2的化合价升高被氧化,生成氧化产物。
解:设质量为X的氧化剂被还原,生成质量为Y的还原产物,生成质量为Z 的氧化产物。
MnO2+ 4HCl![]() MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O
87 146 126 71
X 146g Y Z
![]() =
=![]() ,得X=87g;
,得X=87g;
![]() =
=![]() ,得Y=126g;
,得Y=126g;
![]() =
=![]() ,得Z=87g;
,得Z=87g;
(1)87g÷87g/mol=1mol
(2)146g÷36.5 g/mol÷2=2mol
(3)还原产物126g
(4)71g÷71g/mol×22.4L/mol=22.4L
答:1mol氧化剂被还原,有2mol还原剂被氧化,生成还原产物126g,生成的氧化产物在标准状态下体积为22.4L。


科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它的制备方法如 下图所示,下列说法正确的是
![]()
A.步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1molSi,转移2mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.单晶硅是电子工业中重要的半导体材料,也能用于制作太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室以铜和浓硫酸为原料,采用两种方法制取胆矾。制备方法如下:
方法一:将铜屑放入浓硫酸中加热
(1)写出该反应的化学方程式______________。
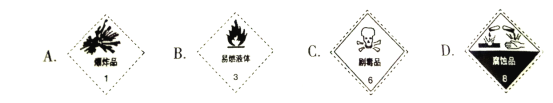
(2)浓硫酸试剂瓶上贴的标签应该是______________(填字母选项)。
(3)通过上述反应后,经过一系列操作,若最终得到胆矾晶体25.0g,则被还原的H2SO4的物质的量为____________mol。
方法二:将铜屑置入稀硫酸中,加热并不断鼓入空气,该反应的化学方程式为:2Cu+ H2SO4+O2![]() 2 CuSO4+2H2O
2 CuSO4+2H2O
(4)写出该反应的离子方程式:____________________________。
(5)上述反应中氧化剂和还原剂的物质的量之比为___________。
(6)充分反应后,将制得的硫酸铜溶液经过蒸发浓缩、___________,过滤,即可得到胆矾晶体。
(7)对比两种方法,方法二相对于方法一有两个明显的优点:
①制取等质量的胆矾消耗的硫酸的量少;
②__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:

(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
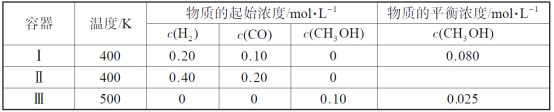
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
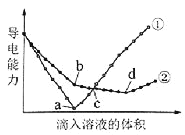
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为外电源,Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:铅蓄电池中的总反应方程式为:
Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
电解的化学方程式:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
对该电解过程,下列判断错误的是( )
A.电解池:溶液的pH减小
B.电解池:SO42-移向Al电极
C.铅蓄电池:负极质量不变
D.铅蓄电池:工作一段时间后,进行充电时铅蓄电池的负极接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取SO2并验证SO2某些性质的装置图,试回答:
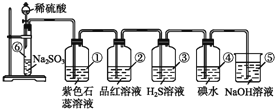
(1)⑥中发生反应的化学方程式为___;
(2)①中实验现象为___,证明SO2是___气体;
(3)②中品红溶液___,证明SO2有___;
(4)③中现象是___,写出SO2与H2O2的化学方程式___;
(5)④中现象是___,证明SO2有___性;
(6)⑤的作用是___,反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com