
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是
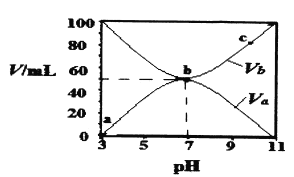
A. Ka(HA)=10-6mol·L-l
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. b→c过程中,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
【答案】C
【解析】A、开始时,0.1mol·L-1HA溶液的pH=3,说明HA为弱酸,同理BOH为弱碱,HA![]() H++A-,c(H+)=c(A-)=10-3mol·L-1,弱电解质的电离微弱,c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式,Ka=10-6×10-6/0.1=10-11,故A错误;B、b点时pH=7,根据电荷守恒,即有c(B-)=c(A+)>c(H+)=c(OH-),故B错误;C、,在b点pH=7,此时的溶质为BA,说明B+水解的程度等于A-水解的程度,b→c过程中,c溶质为BA和BOH,bc段溶液显碱性,是BOH电离的缘故,BOH为弱碱,升高温度,促进电离,c(OH-)增大,对A-+H2O
H++A-,c(H+)=c(A-)=10-3mol·L-1,弱电解质的电离微弱,c(HA)约为0.1mol·L-1,根据电离平衡常数的表达式,Ka=10-6×10-6/0.1=10-11,故A错误;B、b点时pH=7,根据电荷守恒,即有c(B-)=c(A+)>c(H+)=c(OH-),故B错误;C、,在b点pH=7,此时的溶质为BA,说明B+水解的程度等于A-水解的程度,b→c过程中,c溶质为BA和BOH,bc段溶液显碱性,是BOH电离的缘故,BOH为弱碱,升高温度,促进电离,c(OH-)增大,对A-+H2O![]() HA+OH-抑制,c(A-)增大,c(HA)减小,因此c(A-)/c(HA)随着温度的升高而增大,故C正确;D、酸或碱抑制水的电离,盐类水解促进水的电离,因此b点水电离出的c(H+)>10-7mol·L-1,而a、c两点水的电离出的c(H+)<10-7mol·L-1,故D错误。
HA+OH-抑制,c(A-)增大,c(HA)减小,因此c(A-)/c(HA)随着温度的升高而增大,故C正确;D、酸或碱抑制水的电离,盐类水解促进水的电离,因此b点水电离出的c(H+)>10-7mol·L-1,而a、c两点水的电离出的c(H+)<10-7mol·L-1,故D错误。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.伴随能量变化的物质变化也一定是化学变化
B.有化学键变化的一定发生了化学反应
C.化学键断裂时放出能量
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol / L的Na2SO3溶液30 mL,恰好将2×10-3 mol的XO4-离子还原,则元素X在还原产物中的化合价是 ( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是

A. 图1中的每个小黑点表示1个电子
B. 图1中的小黑点表示某一时刻,电子在核外所处的位置
C. 图2表示1s电子只能在球体内出现
D. 图2表明1s轨道呈球形,有无数对称轴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某短周期元素原子的第三电子层上排布有5个电子,则该元素在周期表中的位置是( )
A.第二周期ⅣA族
B.第二周期ⅤA族
C.第三周期ⅣA族
D.第三周期ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知有机物A是一种重要的化工原料,转化关系如下图:
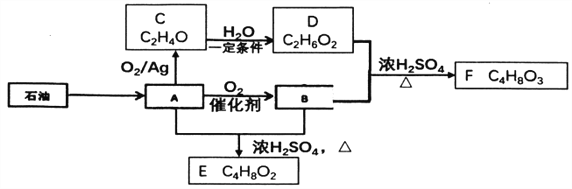
已知:同一碳原子上连接2个或2个以上-OH是不稳定结构,E能发生水解反应
请回答:
(1)A中官能团名称________。
(2)有机物C的结构简式________。
(3)B+D-F的化学方程式是________。
(4)已知![]() 能按下图方式进行裂解:
能按下图方式进行裂解:
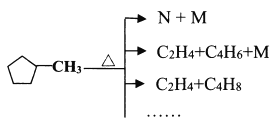
下列说法不正确的是________。
A.可用溴水区分![]() 和N
和N
B.E和![]() 都可以使酸性KMnO4褪色
都可以使酸性KMnO4褪色
C.等质量的A和![]() 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
D.N(五元环)可能的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池B.锌锰干电池中,锌电极是负极
C.甲醇燃料电池可把化学能转化为电能D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com