
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以![]() 与
与![]() 为原料合成化肥尿素的主要反应如下:
为原料合成化肥尿素的主要反应如下:
①![]() ;
;![]()
②![]() ;
;![]()
③![]() ;
;![]()
则a为_________。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:
![]() 。
。
若烟气中![]() 时,通入一定量的空气(
时,通入一定量的空气(![]() 体积分数为
体积分数为![]() ),可利用此法达到最佳脱氮效果。则同温同压下,
),可利用此法达到最佳脱氮效果。则同温同压下,![]() _________。
_________。
(3)工业固氮反应中,在其他条件相同时,分别测定![]() 的平衡转化率在不同压强(
的平衡转化率在不同压强(![]() 、
、![]() )下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),
)下随温度变化的曲线,如图所示正确的是_________(填“A”或“B”),![]() 、
、![]() 的大小关系为
的大小关系为![]() _________
_________![]() (填“>”或“<”或“=”),原因是_________。
(填“>”或“<”或“=”),原因是_________。
A. 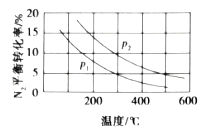 B.
B. 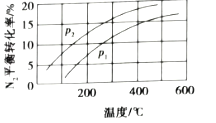
(4)在一定温度下,将![]() 和
和![]() 混合置于
混合置于![]() 密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为
密闭容器中发生工业合成氨反应,2分钟达到平衡状态,测得气体总物质的量为![]() 。
。
①NH3表示该反应的平均速率![]() _________。
_________。
②已知平衡时,容器压强为![]() ,则平衡常数
,则平衡常数![]() _________。(保留2位有效数字)。
_________。(保留2位有效数字)。
(5)电池在生产生活中有广泛的应用,有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________,A是_________(填化学式)。
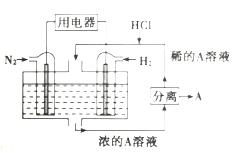
【答案】+73.0 1:1 A < 该反应是气体分子数减小的反应,温度相同时,加压,平衡正向移动,![]() 的平衡转化率增大
的平衡转化率增大 ![]()
![]()
![]()
![]()
【解析】
(1)根据盖斯定律计算即可;
(2)根据反应![]() 分析得最终需要NO和NO2的体积比为1:1,根据反应2NO+O2=2NO2也可以计算出需要转化NO的体积,以及消耗O2的体积,从而算出需要的空气的体积;
分析得最终需要NO和NO2的体积比为1:1,根据反应2NO+O2=2NO2也可以计算出需要转化NO的体积,以及消耗O2的体积,从而算出需要的空气的体积;
(3)工业固氮的化学方程式为:![]() ,该反应是放热反应,也是气体体积减小的反应,据此分析;
,该反应是放热反应,也是气体体积减小的反应,据此分析;
(4)列出反应的三段式分析即可;
(5)N2和H2反应生成NH3,但溶液中含有HCl,故A为NH4Cl;由于N2作氧化剂,发生还原反应,故左侧电极为正极,其电极反应为![]() 。
。
(1)由题知:2×①+②=③,则②=③-2×①,即△H2=△H3-2△H1=(-87kJ·mol-1)-2×(-80kJ·mol-1)=+73kJ·mol-1;
(2)烟气中![]() ,则假设V(NO)=5L,V(NO2)=1L,根据反应
,则假设V(NO)=5L,V(NO2)=1L,根据反应![]() 可得NO和NO2 的体积比为1:1,由于2NO+O2=2NO2,故消耗2L NO反应生成2L NO2即可,该反应中消耗O2 1L,即需要空气5L,则
可得NO和NO2 的体积比为1:1,由于2NO+O2=2NO2,故消耗2L NO反应生成2L NO2即可,该反应中消耗O2 1L,即需要空气5L,则![]() 5:5=1:1;
5:5=1:1;
(3)工业固氮的化学方程式为:![]() ,该反应是放热反应,则压强不变时,随着温度的升高,平衡逆向移动,则N2的平衡转化率降低,故选A;温度相同时,由于该反应是气体体积减小的反应,增大压强,平衡正向移动,N2的平衡转化率升高,故p1<p2;
,该反应是放热反应,则压强不变时,随着温度的升高,平衡逆向移动,则N2的平衡转化率降低,故选A;温度相同时,由于该反应是气体体积减小的反应,增大压强,平衡正向移动,N2的平衡转化率升高,故p1<p2;
(4)设达到平衡时,N2的转化的量为x mol,则
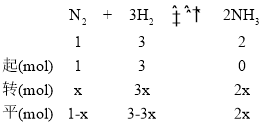 ,(1-x)+(3-3x)+2x=2.8,解得x=0.6,即
,(1-x)+(3-3x)+2x=2.8,解得x=0.6,即
 ,
,
①v(NH3)=![]() =0.3mol/(L·min);
=0.3mol/(L·min);
②根据PV=nRT可知,气体的分压和其物质的量成正比,则Kp=![]() =
=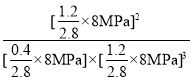 =0.26(MPa)-2;/span>
=0.26(MPa)-2;/span>
(5)N2和H2反应生成NH3,但溶液中含有HCl,故A为NH4Cl;由于N2作氧化剂,发生还原反应,故左侧电极为正极,其电极反应为![]() 。
。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
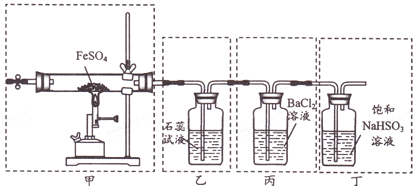
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
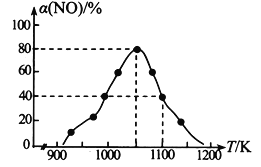
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
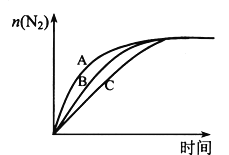
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
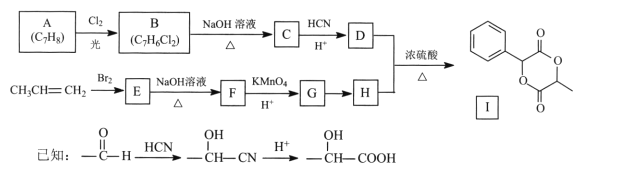
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
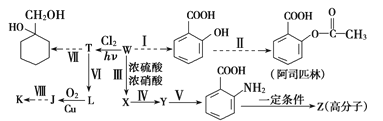
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照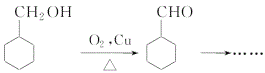 )_______
)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com