
下列液体均处于25 ℃,有关叙述正确的是 ( )。
A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐
B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同
C
【解析】本题考查了溶液中离子浓度的大小比较、溶解度等知识,意在考查考生对电解质溶液、电离与水解平衡等知识的理解能力。碱性溶液可能是碱、强碱弱酸盐的溶液,也可能是弱酸弱碱盐的溶液,A项错。pH是溶液中H+浓度的负对数,pH相差2个单位,c(H+)相差100倍,pH=4.5的H2SO4溶液中c(H+)是pH=6.5的牛奶中c(H+)的100倍,B项错。pH=3的醋酸溶液的物质的量浓度大于pH=11的NaOH溶液的物质的量浓度,两者等体积混合时醋酸过量,溶液呈酸性,溶液中各离子浓度关系正确,C正确;溶液中Cl-浓度影响AgCl的溶解度,等浓度的CaCl2溶液和NaCl溶液中Cl-浓度不同,AgCl的溶解度不同,D项错。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③④ C.②③⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:选择题
体积为1 L的某溶液中含有的离子如表所示:
离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 1 | 1 | a | 1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是 ( )。
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:填空题
25 ℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.0×10-8 |
回答下列问题。
(1)物质的量浓度为0.1 mol·L-1的下列四种物质,pH由大到小的顺序是________(填编号)。
a.Na2CO3 b.NaClO
c.CH3COONa d.NaHCO3
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列各量一定变小的是________(填编号)。
A.c(H+) B.c(CH3COO-)
C.c(H+)·c(OH-) D.
(3)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是__________________;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_________________________________________________________________。

(4)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填精确数值)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol· L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
下列条件一定能使反应速率加快的是 ( )。
①增加反应物的物质的量 ②升高温度 ③增大反应体系的压强 ④不断分离出生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )。
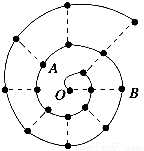
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com