
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛。下图是利用乙酰丙酸(![]() )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):

已知:![]()
![]() ,(R、R′表示烃基)
,(R、R′表示烃基)
(1)A中含有的官能团是_______________(填官能团名称)。
(2)B与D的反应类型为_______________,B的结构简式为______________________
(3)C生成D的反应化学方程式为______________________。
(4)C分子的核磁共振氢谱中有_________个吸收峰;同时符合下列要求的C的同分异构体有_______种。①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色
F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为_____________
(5)根据合成聚芳酯E的路线,请你以苯酚及2-丙醇为原料(无机试剂任选),设计合成G: 的路线。___________
的路线。___________
【答案】羟基、羧基 缩聚反应 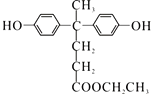
 +2SOCl2→
+2SOCl2→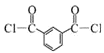 +2SO2+2HCl 4 10 4mol
+2SO2+2HCl 4 10 4mol 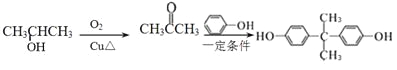
【解析】
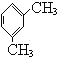 被酸性高锰酸钾氧化生成的C为
被酸性高锰酸钾氧化生成的C为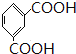 ,C中羧基上的羟基被氯原子取代生成的D为
,C中羧基上的羟基被氯原子取代生成的D为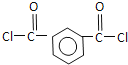 ,由聚芳酯E的结构简式可知B的结构简式为
,由聚芳酯E的结构简式可知B的结构简式为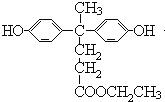 ,A的分子式为C17H18O4,A与CH3CH2OH反应生成B,则A的结构简式为
,A的分子式为C17H18O4,A与CH3CH2OH反应生成B,则A的结构简式为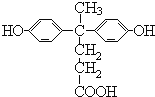 。
。
 被酸性高锰酸钾氧化生成的C为
被酸性高锰酸钾氧化生成的C为 ,C中羧基上的羟基被氯原子取代生成的D为
,C中羧基上的羟基被氯原子取代生成的D为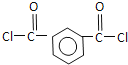 ,由聚芳酯E的结构简式可知B的结构简式为
,由聚芳酯E的结构简式可知B的结构简式为 ,A的分子式为C17H18O4,A与CH3CH2OH反应生成B,则A的结构简式为
,A的分子式为C17H18O4,A与CH3CH2OH反应生成B,则A的结构简式为 。
。
(1)A的结构简式为 ,含有的官能团是:羧基、羟基;
,含有的官能团是:羧基、羟基;
(2)B与D的反应类型为缩聚反应,B的结构简式为 ;
;
(3)根据以上分析可知C生成D的反应化学方程式为: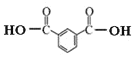 +2SOCl2→
+2SOCl2→ 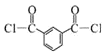 +2SO2+2HCl;
+2SO2+2HCl;
(4)C的结构简式为 ,因此核磁共振氢谱中有4个吸收峰;同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为-OH、-COOH、-CHO,当-OH、-COOH处于邻位时,-CHO有4种位置,当-OH、-COOH处于间位时,-CHO有4种位置,当-OH、-COOH处于对位时,-CHO有2种位置,共有10种;F与C属于官能团异构的同分异构体,且只含一种官能团,则F为
,因此核磁共振氢谱中有4个吸收峰;同时符合下列要求的C的同分异构体:①能发生银镜反应,说明含有醛基,②能与NaHCO3溶液反应,说明含有羧基,③遇FeCl3溶液显紫色,说明含有酚羟基,则取代基为-OH、-COOH、-CHO,当-OH、-COOH处于邻位时,-CHO有4种位置,当-OH、-COOH处于间位时,-CHO有4种位置,当-OH、-COOH处于对位时,-CHO有2种位置,共有10种;F与C属于官能团异构的同分异构体,且只含一种官能团,则F为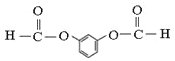 ,1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为4mol;
,1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为4mol;
(5)结合转化关系中![]() 与苯酚转化为A的反应可知,2-丙醇催化氧化生成丙酮
与苯酚转化为A的反应可知,2-丙醇催化氧化生成丙酮![]() ,丙酮与苯酚反应得到
,丙酮与苯酚反应得到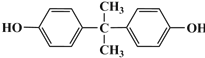 ,因此合成路线流程图可设计为:
,因此合成路线流程图可设计为: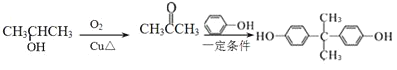 。
。


科目:高中化学 来源: 题型:
【题目】可逆反应:X(s)+Y(g)![]() 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A. 仅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。


(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族,G的最外层只有1个电子。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出E的电子排布式____________,E位于周期表____区。
(2)B、C、D的第一电离能由小到大的顺序为___________。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_________(填结构简式)
(4)![]() 的空间构型为___________,键角为_______。
的空间构型为___________,键角为_______。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则第二种配合物的化学式为_______
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有___个B原子。若晶胞的棱长为acm,则它的密度为____g/cm3(NA表示阿伏加德罗常数)
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为________,该晶体中氧原子的配位数为_______。
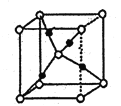
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
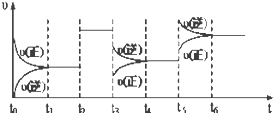
A.t3时降低了温度
B.t5时增大了压强
C.t2时加入了催化剂
D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+,2CH3COOH +2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为______。
(2)NH3分子空间构型为_______, 其中心原子的杂化类型是______。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_______,1mol CH3COOCH=CH2中含![]() 键数目为_____。
键数目为_____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为__________。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )、环氧丙烷(
)、环氧丙烷(![]() )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①![]()
![]()
②2![]()
![]()
![]()
③![]()
![]()
![]()
![]() _____
_____![]()
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为____,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____(填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____。
③该反应的平衡常数K_____(精确到0.01)。
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____。
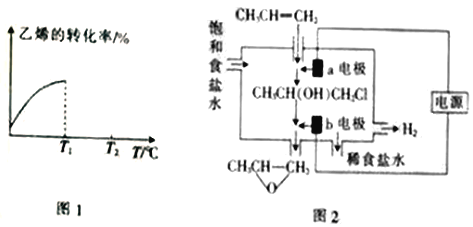
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______。
②b电极区域生成环氧丙烷的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com