
【题目】在一定条件下CO2与NH3混合反应,可以合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
A.CO2与H2O(g)浓度相等
B.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆
D.容器中混合气体的密度不再改变
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如图:
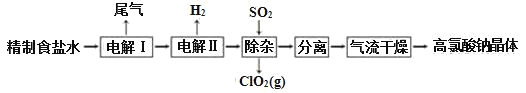
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
除去盐水中的Br-可以节省电解过程中的电能,其原因是_____。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有_____(填化学式)。“电解Ⅱ”的化学方程式为____。
(3)“除杂”的目的是除去少量的未反应的NaClO3杂质,该反应的离子方程式为_____。“气流干燥”时,温度控制在80~100℃,温度不能过高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向Na2SO3溶液中滴加稀HNO3: SO32-+2H+= SO2↑+H2O
B.用过量氨水吸收工业尾气中的SO2:NH3·H2O+SO2= NH4++HSO3-
C.Fe和稀硝酸反应:Fe+2H+=Fe2++H2↑
D.向NH4HCO3溶液中加入过量浓NaOH溶液并加热: NH4++ HCO3-+2OH-![]() CO32-+ NH3↑+2H2O
CO32-+ NH3↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A. 在自然界中只以化合态的形式存在
B. 单质常用作左半导体材料和光导纤维
C. 最高价氧化物不与酸反应
D. 气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确且能合理解释事实的是 ( )
A.由H和Cl形成共价键的过程:![]()
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后,溶液变蓝:4H+ +4I- +O2=2I2 +2H2O
D.向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)=C(g)+D(g)已达到平衡状态
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体总质量⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g)![]() 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__。
(2)合成NH3达到平衡后,某时刻改变下列条件__(填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
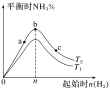
①图象中T2和T1的关系是:T2__T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
T1 | 30% | 50% | 80% | 80% |
T2 | 35% | 60% | a | b |
上表中a、b、80%三者的大小关系为___。(填“>”“=”“<”或“无法比较”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com