
【题目】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g)![]() 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__。
(2)合成NH3达到平衡后,某时刻改变下列条件__(填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
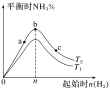
①图象中T2和T1的关系是:T2__T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
T1 | 30% | 50% | 80% | 80% |
T2 | 35% | 60% | a | b |
上表中a、b、80%三者的大小关系为___。(填“>”“=”“<”或“无法比较”)
【答案】(1.5c-a-b)kJ A < c 0.02 a=b<80%
【解析】
(1)根据盖斯定律计算反应的焓变,根据反应放出的热量与物质的量成正比;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动;
(3)①根据温度升高化学平衡向着吸热方向进行;
②根据a、b、c三点所表示的意义来回答;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,但温度低,反应速率慢。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=(2a+2b-3c)kJ·mol-1;
则34g 即2mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为![]() ×[-(2a+2b-3c)] kJ=(1.5c-a-b)kJ ;
×[-(2a+2b-3c)] kJ=(1.5c-a-b)kJ ;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,所以改变条件应为升温,反应速率增大,平衡逆向移动,而加压、增大c(N2)、降低c(NH3)平衡都正向移动,故选A;
(3)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氨气的分数增加,故T1>T2,即:T2<T1;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,
故选c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当起始氢气的物质的量为0.15mol时氨的含量最大,故起始加入N2的物质的量为0.05mol,所以起始时氮气的浓度是0.05mol·L-1,平衡时0.05mol·L-1×(1-60%)=0.02mol·L-1;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,所以a>80%,但温度低,反应速率慢,所以T2时反应可能达到平衡也可能未达平衡,所以a=b或a<b,所以80%<a=b或80%<a<b。


科目:高中化学 来源: 题型:
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO2与NH3混合反应,可以合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
A.CO2与H2O(g)浓度相等
B.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆
D.容器中混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4 mL(标准状况下)气体,反应消耗的HNO3的物质的量可能是 ( )
A.1.0×10-3 molB.1.6×10-3 molC.2.2×10-3 molD.2.4×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:
①0.1mol/L硫酸、②小苏打、③纯碱、④二氧化碳、⑤葡萄糖、⑥0.1mol/LNaOH溶液、 ⑦氢氧化铁胶体、⑧氨水、⑨Al2O3、⑩硫酸铁溶液
(1)上述十种物质中,属于非电解质的有___(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是___(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是___(填序号)。
(4)现有100mL⑩溶液中含Fe3+5.6g,则溶液中c(SO42-)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的电离:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
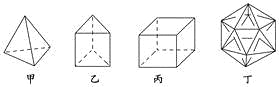
A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com