
【题目】下表是元素周期表的一部分,每个编号代表一种元素,请根据要求回答问题:
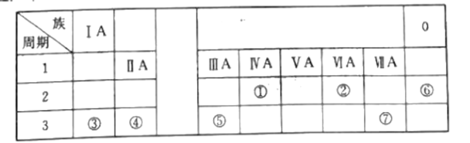
(1)表中金属性最强的元素为___(填元素符号);
(2)最稳定的元素为___(填元素符号);
(3)③、⑦的原子半径大小关系:③___(填“>”“<”或“=”)⑦);
(4)④和⑦两种元素组成的化合物与AgNO3溶液反应的离子方程式为___。
【答案】Na Ne > C1-+Ag+=AgCl↓
【解析】
根据周期表中的位置各元素为①C②O③Na④Mg⑤Al⑥Ne⑦Cl。
(1)周期表中同主族从上到下,同周期从右到左,金属性增强,表中金属性最强的元素为Na(填元素符号);故答案为:Na;
(2)稀有气体最外层已经达到稳定结构,最稳定的元素为Ne(填元素符号);故答案为:Ne;
(3)同周期从左到右原子半径逐渐减小,③、⑦的原子半径大小关系:③>(填“>”“<”或“=”)⑦);故答案为:>;
(4)④和⑦两种元素组成的化合物MgCl2与AgNO3溶液反应生成氯化银和硝酸镁,离子方程式为C1-+Ag+=AgCl↓。故答案为:C1-+Ag+=AgCl↓。


科目:高中化学 来源: 题型:
【题目】向10.00 mL 0.50 mol/L NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
实验 | 序号 | c(CaCl2)(mol·L-1) | 滴加CaCl2溶液时的 实验现象 | 加热浑浊液时的 实验现象 |
| ① | 0.05 | 至1.32 mL时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
② | 0.005 | 至15.60 mL时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
③ | 0.0005 | 至20 mL未见浑浊 |
A.①中产生浑浊的原因是c(Ca2+)·c(CO32)>Ksp(CaCO3)
B.未加热前①和②中发生了反应:2HCO3-+Ca2+=CaCO3↓+H2CO3
C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D.向上述NaHCO3溶液中加入足量0.5 mol/LCaCl2溶液,可能同时产生浑浊和气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化。丙烷(C3H8)是一种优良的燃料,如图是一定量丙烷在常温常压下完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:
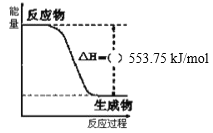
(1)写出丙烷燃烧热的热化学方程式:___。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO和液态水共放出1607 kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
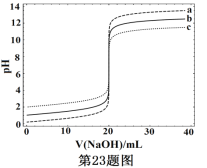
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )

A.t5时增大了压强
B.t3时降低了温度
C.t2时加入了催化剂
D.t4~t5时间内X或Y转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为____。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
(II)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:_____。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | A的分子式为:________。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况) | 写出A中含有的官能团____________、________。 |
(4)A的核磁共振氢谱如下图: | 综上所述,A的结构简式为________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
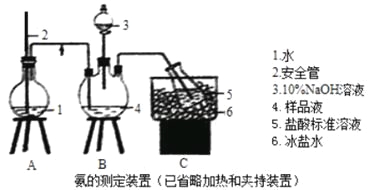
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A. l mol OH﹣所含电子数为10NA
B. 2L0.5 molL﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 L CC14含有的氯原子数为0.2NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com