
【题目】如图所示是粗盐提纯实验操作步骤,其名称为_____________(填“溶解”、“过滤”或“蒸发”),该步骤用到的玻璃仪器有:烧杯、玻璃棒和__________。实验结束后,取精盐配制成0.05L含NaCl 0.05mol 的食盐水,其浓度为___________________; 氯化钠中钠原子和氯原子之间形成的化学键属于__________(填“离子键”或“共价键”);实验室常用AgNO3来检验Cl-的存在,写出其离子方程式_____________________________。

科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
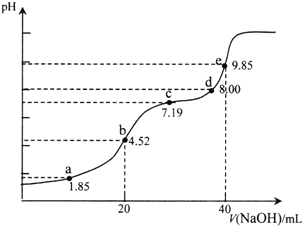
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试完成下列问题:(提示:氢氧化钙的溶解度随温度升高而降低)

(1)实验中观察到的现象是______________________________________;
(2)产生上述现象的原因是______________________________________。
(3)写出有关反应的离子方程式____________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)如将本题中“25℃石灰水饱和溶液”换成“20℃碳酸饮料”进行探究实验,实验(1)中观察到的另一现象是________________,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列七个反应:①煅烧石灰石制生石灰 ②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败 ⑦碳与水蒸气反应制得水煤气。其中放热反应的一组是( )
A. ①⑦B. ①⑤⑦C. ②③④⑥D. ②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com