
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
【答案】C
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+。
A项、a电极为该电池的负极,负极反应生成氢离子,为维持溶液呈电中性,咸水中阴离子Cl-移向负极室左室,则离子交换膜I是氯离子交换膜,故A错误;
B项、电解质溶液中阴离子Cl-移向负极室左室,a电极附近溶液的氯离子浓度增大,b电极消耗氢离子,溶液的pH增大,故B错误;
C项、a电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故C正确;
D项、放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D错误。
故选C。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e在周期表中的相对位置如图所示。已知a元素形成的物质种类最多。
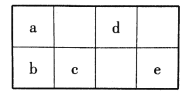
回答下列问题:
(1)在周期表中,b在元素周期表中的位置为______。
(2)b、c、e的气态氢化物热稳定性由强到弱的顺序为_____(用化学式表示)。
(3)在d的氢化物中,既含极性键又含非极性键的分子的电子式为____。
(4)a的单质在过量的d的单质气体中燃烧生成气态产物,转移1mol电子时放出的热量为98.75kJ。写出反应的热化学方程式:_______。
(5)请写出e单质与石灰乳制成漂白粉的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。

下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 中和滴定实验中,锥形瓶用蒸馏水洗净须经烘箱烘干后才可使用
C. 配制0.5mol·L-1480mL的NaOH溶液需称量9.6 g NaOH固体
D. 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:

其中:A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是______,A的电子式为_______,C中含有官能团名称______;
(2)A→B反应类型____________;C→D反应类型______________
(3)写出下列转化的化学方程式
①A→B:________________________________________________________,
②C→D:__________________________________________________________,
③CH3CH2OH→CH3CHO:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是粗盐提纯实验操作步骤,其名称为_____________(填“溶解”、“过滤”或“蒸发”),该步骤用到的玻璃仪器有:烧杯、玻璃棒和__________。实验结束后,取精盐配制成0.05L含NaCl 0.05mol 的食盐水,其浓度为___________________; 氯化钠中钠原子和氯原子之间形成的化学键属于__________(填“离子键”或“共价键”);实验室常用AgNO3来检验Cl-的存在,写出其离子方程式_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是

A. 放电时,正极的电极反应式为 Fe2O3+6Li++ 6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe作电池的负极,Fe2O3作电池的正极
D. 充电完成后,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的乙烯,完全燃烧时放出的热量为Q,完全吸收燃烧后所生成的CO2气体需要200mL 2mol/L的NaOH溶液,则28g乙烯完全燃烧放出的热量不可能是
A. 5QB. 5Q~10QC. 10QD. 大于10Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
____Mn2++____H5IO6===_____MnO4-+____IO3-+_____H++_____
(2)根据以上离子方程式判断H5IO6是_____酸(填“强”或“弱”)。
(3)上述反应,被氧化的元素是_____(填元素符号),该反应的转移电子数______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com