
【题目】I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明_____对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________。
A. t1<70 B.t1>t4 C.m12 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________mol/L。
II.己知在 25℃、l0l kPa 下,2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
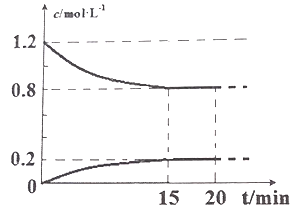
(1) 015min 内,v(CO2) =__________________。
(2)该反应的速率时间图像如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图像如下图中右图所示。以下说法正确的是______(填对应字母)。
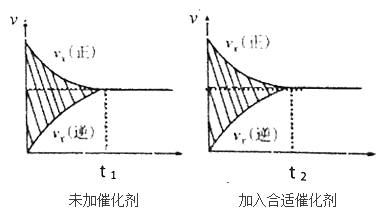
A.a1>a2 B.b12 C.t1>t2
(3) 一定条件下,己知反应NO2(g)+SO2(g) ![]() NO(g)+SO3(g),将NO2
NO(g)+SO3(g),将NO2
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO
【答案】 温度 ②、③和⑤ AD CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率。 2.4 mol/L 0.027 BC bc
【解析】I.(1)实验①和实验②的外界条件只有温度不同,其它因素完全相同,其不同点就是研究目的,所以实验目的是探究温度对化学反应速率影响;③和④中只有温度相同其它因素都相同,所以③和④也是探究温度对化学反应速率的影响;研究锌的形状对反应速率的影响时,应该只有锌的形状不同,其它因素完全相同,所以应该选取 ②、③和⑤;锌和稀硫酸反应生成硫酸锌和氢气,反应方程式为Zn+H2SO4(稀)=ZnSO4+H2↑;
(2)A.由于实验3和实验5中,只有锌的规格不同,而实验5的锌为粉末,接触面积大,反应速率比实验3大,所以t1<70,故A正确;B.实验5和实验8,只有锌的质量不同,其它条件完全相同,实验5中生成的硫酸锌质量少,需要的时间短,即t1<t4,故B错误;C.由于实验1和实验2中反应物的量完全相同,所以生成的硫酸锌的质量一定相等,即m1=m2,故C错误;D.从表中数据可知,从实验8开始,硫酸完全反应,所以m6=19.3,故D正确;故选AD;
(3)CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,锌作负极、Cu作正极而加快了H2产生的速率;
(4)根据表中数据可知,从实验8开始,硫酸完全反应,生成的硫酸锌的质量为19.3g,硫酸锌的物质的量为: ![]() =0.12mol,硫酸的浓度为:
=0.12mol,硫酸的浓度为: ![]() =2.4mol/L;
=2.4mol/L;
II.(1)由2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)反应可知, 015min内CO2的浓度变化与反应物NO或CO的浓度变化相同,则 v(CO2) =
N2(g)+2CO2(g)反应可知, 015min内CO2的浓度变化与反应物NO或CO的浓度变化相同,则 v(CO2) =![]() =0.027mol/(L·min);
=0.027mol/(L·min);
(2)加入催化剂,反应速率加快,所以b1<b2,到达平衡的时间缩短,所以t1>t2,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等,
故答案为BC;
(3) a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;b.混合气体颜色保持不变,说明NO2的量一定,说明达到平衡状态,故b正确;c.NO2和SO2的体积比保持不变,说明达到平衡状态,故c正确;d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误;故选bc;


科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
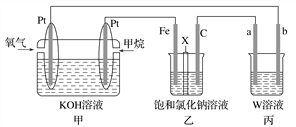
(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Mg(OH)2]=2.0×10-11,Ksp[Mn(OH)2]=2.0×10-13。该温度下,关于含有Mg(OH)2和Mn(OH)2两种固体的悬浊液,下列说法正确的是
A. 溶液中的![]()
B. 若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小
C. 若加入少量MgCl2,溶液中的c(Mg2+)和c(Mn2+)均增大
D. 若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A. 2.24LCO2中含有的原子数为0.3 ×6.02×1023
B. 0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D. 4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列与化学有关的说法正确的是( )
A. 液氨汽化时能吸收大量的热,故可用作制冷剂
B. SO2能漂白纸浆等,故可广泛用于食品的漂白
C. 味精的主要成分是蛋白质,烧菜时可加入适量
D. 氢氟酸可用于雕刻玻璃制品,这是利用酸的通性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
B.硅的化学性质不活泼,在常温下不与任何物质反应
C.硅在电子工业中是最重要的半导体材料
D.硅的性质很稳定,能以单质的形式存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O===Q+S+H2S↑ (已配平),则物质Q是
A. Fe2O3 B. FeO C. Fe(OH)2 D. Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(![]() )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为:![]()
![]() 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多的“守恒或相等“下列说法不正确的是
A. 化学反应中,反应物总能量与生成物总能量
B. 溶液中,阳离子电荷总数与阴离中电荷总数
C. 溶液中,稀释前后溶质质量与稀释后溶质质量
D. 化学反应中,参加反应物总质量与生成物总质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com