
【题目】在一支25 mL的酸式滴定管中加入0.1 mol/L的HCl溶液,其液面恰好在5 mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后用0.1 mol/L的NaOH溶液进行中和,则所需NaOH溶液的体积( )
A. 等于5 mL B. 大于20 mL C. 等于20 mL D. 小于20 mL
科目:高中化学 来源: 题型:
【题目】加热条件下,硅单质和HCl反应生成SiHCl3是粗硅提纯的重要步骤。某小组设计如图所示装置完成上述转化(夹持装置略去)。
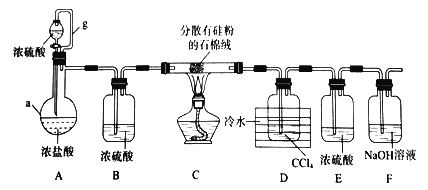
已知:SiHCl3的沸点为33.0°C,易溶于有机溶剂,能与水剧烈反应,在空气中易被氧化,CCl4的沸点为76.8°C。请回答:
(1)仪器a的名称为 ;导管g的作用为 ;
(2)装置A中,浓硫酸体现的性质为 ;实验时,需先打开分液漏斗活塞,一段时间后,在点燃C处酒精灯,理由是 ;
(3)装置C中发生反应的化学方程式为 ;
(4)装置D中所得的液态混合物的分离方法为 。(填操作名称)
(5)反应后的气体通过装置F中的NaOH溶液后,对逸出气体的处理方法为 ;
(6)SiHCl3在潮湿的空气中被氧化,生成一种氧化物和一种无氧酸,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已知可逆反应:M(g)+N(g) ![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
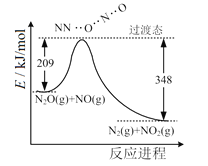
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
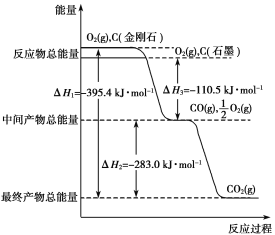
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:_______________________。注意:石墨用“C(石墨,s)”表示。
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定。
(3)6 g石墨在一定量空气中燃烧,生成气体18 g,该过程中放出的热量为______________kJ。
Ⅱ.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
4P(红磷,s)+5O2(g)= 4 P4O10(s) ΔH2=-2954 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式:4P(红磷,s) ==P4(白磷,s)ΔH=____________
(2)已知298 K时白磷不完全燃烧的热化学方程式为:P4(白磷,s)+3O2(g)=P4O6(s) ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为_________________,反应过程中放出的热量为___________kJ。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):
P—P:198,Cl—Cl :243,P—Cl:331。
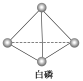
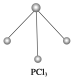
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.4 mol OH-的质量为 ,其中含有 个电子。
(2)质量比为16:7:6的三种气体SO2、CO、NO氧原子个数之比为 ;同条件下体积比为 。
(3)标准状况下,1体积水能溶解448体积HCI,所得溶液的密度为1.1 g/mL,该溶液的质量分数和物质的量的浓度分别是 、 。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是

A.外电路电子从B极移向A极[来
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小[
D.A极电极反应式为:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如右图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
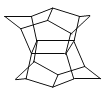
A.分子式为C20H20
B.一氯代物的同分异构体只有两种
C.分子中含有4个亚甲基(—CH2—)
D.分子中含有12个五元碳环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com