
【题目】下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
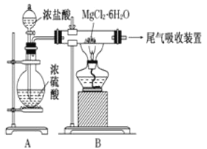
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl26H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
【答案】B
【解析】
A.浓硫酸有吸水性,浓盐酸有挥发性,将浓盐酸加入到浓硫酸中会产生HCl气体,在酸性环境中可以抑制Mg2+水解而制取无水氯化镁,若将浓硫酸换为MnO2,则不能产生HCl,因此不能得到无水氯化镁,错误;
B.如果直接加热MgCl26H2O,则MgCl2水解,不能得到无水氯化镁,将得到Mg(OH)Cl或MgO,正确;
C.尾气中含有HCl,不能被浓硫酸吸收,应该用水作吸水剂,由于HCl极容易溶于水,因此在用水作吸水剂时要注意防止倒吸现象的发生,错误;
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,由于Mg可以与CO2发生反应,因此不能用二氧化碳灭火器进行灭火,错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】根据如图所示的N2(g)和02(g)反应生成NO(g)过程中的能量变化情况判断,下列说法正确的是

A.N2(g)和O2(g)反应生成NO(g)是放热反应
B.2 mol O原子结合生成O2(g)时需要吸收498 kJ能量
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量
D.2 mol N(g)和2 mol O(g)的总能量为1444 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得平衡后n(Cl2)=2.5×10-2 mol,10 min内υ(ClNO)=________________,则NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 ________α1(填“>”、“<”或“=”),
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g) + 5O2(g)![]() 4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
4NO(g) + 6H2O(g) △H =-906 kJ·mol-1
II.4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) △H = -1266 kJ·mol-1
在1L的密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量与反应温度的关系如图所示。

①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2” 或“T3”)
②写出N2和O2生成NO的热化学方程式________。
③温度为T2时,反应II的平衡常数K =_________________(只列算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有Cr2O72-,为了处理有毒的Cr2O72-,需要先测定其浓度:取20 mL废水,加入适量稀硫酸,再加入过量的V1 mL c1 mol·L-1(NH4)2Fe(SO4)2溶液,充分反应(还原产物为Cr3+)。用c2 mol·L-1 KMnO4溶液滴定过量的Fe2+至终点,消耗KMnO4溶液V2 mL。则原废水中c(Cr2O72-)为(用代数式表示)( )
A. ![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________________
(2)过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式_________;氧化产物与还原产物的物质的量之比为________。
(3)除去废液中的AsCl3,是用次磷酸钠(NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应的化学反应方程式为______________________氧化剂和还原剂的物质的量之比为________,氧化产物是________。
(4)FeS被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS与Cl2反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:

已知:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cr(OH)3]=6.4×10-31。
(1)若以氧化物形式表示矿物的组成,则Fe2SiO4可表示为____________。
(2)焙烧时通入氧气的作用是__________________________________________
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43-、AsO43-、SiO32-反应,使其分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。测得反应pH与除杂率的关系如图所示。

①反应过程中控制溶液pH为9,pH>9时除杂率降低的原因是_________。
②反应的温度控制在80 ℃左右,温度不宜太高的主要原因是___________。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)。
①完成“还原”反应的离子方程式:________Cr2O72-+________S2O32-+________===________Cr3++________SO42-+________
②已知铬液中c(Cr2O72-)=0.32 mol·L-1,为了不在还原过程中产生Cr(OH)3沉淀,应控制溶液的pH不大于________。
(5)“沉铬”的主要副产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

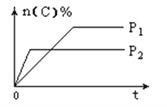
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com