
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原予的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:
(1) A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为_________(用元素符号表示)。
(2) A与HF相比,其熔、沸点较低,原因是___________。
(3) B分子属于________(填“极性”或“非极性”)分子。
(4) D分子中心原子的杂化方式是________,由该原子组成的单质分子中包含________个π键,与该单质分子互为等电子体的常见分子的分子式为________。
(5) [Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请画出[Fe(NO)(H2O)5]2+结构示意图:___。
【答案】N>O>Cl>S HF分子间形成氢键 极性 sp3 2 CO 
【解析】
常见的18电子的二元化合物有:HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6;D可作为火箭推进剂的燃料,且原子个数为6,原子个数比为1:2,应为N2H4;A、C分子中两种原子的个数比均为1:1,A含有2个原子则A应为HCl,C含有4个原子,则C应为H2O2;B含有3个原子,个数比为1:2,应为 H2S。
(1)A、B、C、D分子中相对原子质量较大的四种元素分别为Cl、S、O、N,同周期元素自左至右第一电离能呈增大趋势,但N原子核外2p能级半满,更稳定,所以第一电离能大于O;同主族元素自上而下第一电离能减小,所以四种元素第一电离能由大到小排列顺序为N>O>Cl>S;
(2)由于HF分子间存在氢键,所以HF的沸点高于HCl;
(3)B为H2S,分子为V形,正负电荷中心不重合,为极性分子;
(4)D为N2H4,中心N原子与两个H原子形成2个σ键,与另一个N原子形成1个σ键,还有一对孤电子对,所以价层电子对数为4,为sp3杂化;N原子组成的单质为N2,分子中含一个氮氮三键,其中有2个π键;原子总数相同,价电子总数也相同的分子、离子或基团互为等电子体,所以与N2互为等电子的分子为CO;
(5)[Fe(NO)(H2O)5]2+中NO以N原子与Fe2+形成配位键,水分子中O原子含有孤电子对,所以H2O以O原子与Fe2+形成配位键,[Fe(NO)(H2O)5]2+的结构示意图为 ;
;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和六氧化四磷(P4O6)的分子结构如图所示。现提供以下化学键的键能(单位:kJ/mol):P—P:198;P—O:360;O=O:498。则1 mol P4(白磷)燃烧P4( 白磷)+3O2(g)![]() P4O6(g)时的能量变化为( )
P4O6(g)时的能量变化为( )
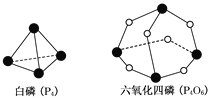
A.吸热1638 kJB.放热1638 kJC.吸热126 kJD.放热126 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上可用作杀菌剂。以废铜(主要杂质为Fe)为原料,经溶解氧化、调节pH、过滤等步骤,可制备氯氧化铜。
(1)工业上用H2O2和HCl溶解氧化废铜时,反应生成Cu2+时的离子方程式为________。
(2)加Cu2(OH)2CO3调节混合液pH时,其优点是________。
(3)为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜固体,放入锥形瓶中,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL(已知Ag2CrO4为砖红色沉淀)。
步骤Ⅱ:称取0.2235 g氯氧化铜固体,放入锥形瓶中,加入一定量硫酸使固体完全溶解。溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液10.00 mL。
已知步骤Ⅱ中所发生的反应如下:2Cu2++4I-===2CuI↓+I2;2Na2S2O3+I2===2NaI+Na2S4O6。
①步骤Ⅰ滴定终点时的实验现象是_____。
②通过计算确定氯氧化铜的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。
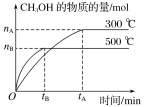
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A.熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
B.密度:CCl4>苯>H2O
C.同质量的物质燃烧耗O2量:甲烷>乙烯>乙炔
D.同物质的量的下列物质燃烧耗O2量:环已烷>苯=乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
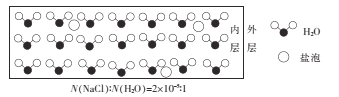
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下:
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________(填字母)。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
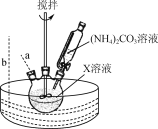
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________(填“a”或“b”)处。
(3) “步骤Ⅱ”采用高压密封加热的目的是________。
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有____________,煅烧时发生反应的化学方程式为________。
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:________________________。(实验须使用的试剂:蒸馏水、乙醇)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com