
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上可用作杀菌剂。以废铜(主要杂质为Fe)为原料,经溶解氧化、调节pH、过滤等步骤,可制备氯氧化铜。
(1)工业上用H2O2和HCl溶解氧化废铜时,反应生成Cu2+时的离子方程式为________。
(2)加Cu2(OH)2CO3调节混合液pH时,其优点是________。
(3)为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜固体,放入锥形瓶中,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.100 0 mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL(已知Ag2CrO4为砖红色沉淀)。
步骤Ⅱ:称取0.2235 g氯氧化铜固体,放入锥形瓶中,加入一定量硫酸使固体完全溶解。溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液10.00 mL。
已知步骤Ⅱ中所发生的反应如下:2Cu2++4I-===2CuI↓+I2;2Na2S2O3+I2===2NaI+Na2S4O6。
①步骤Ⅰ滴定终点时的实验现象是_____。
②通过计算确定氯氧化铜的化学式(写出计算过程)__________。
【答案】Cu+2H++H2O2===Cu2++2H2O 调节溶液的酸碱性,不引入杂质,使Fe3+全部转化为Fe(OH)3沉淀等 当加入最后一滴AgNO3溶液时,出现砖红色沉淀 0.4470g氯氧化铜Cl-离子的物质的量:n(Cl-)=n(AgNO3)=0.1000mol·L-1×0.02L=0.002mol根据题意:2Cu2+~I2~2Na2S2O3 则0.2235g氯氧化铜固体中:n(Cu2+)=n(Na2S2O3)=0.2000mol·L-1×0.01L=0.002mol可知0.4470g氯氧化铜中含有:n(CuCl2)=0.001mol,n(CuO)=0.003mol,根据质量守恒有n(H2O)=(0.4470g-0.001mol×135g·mol-1-0.003mol×80g·mol-1)÷18g·mol-1=0.004mol,n(CuO)∶n(CuCl2)∶n(H2O)=3∶1∶4,则晶体的化学式为3CuO·CuCl2·4H2O
【解析】
(1)Cu与H2O2和HCl反应的化学方程式为:![]() ,拆写成离子方程式为:Cu+2H++H2O2===Cu2++2H2O;
,拆写成离子方程式为:Cu+2H++H2O2===Cu2++2H2O;
(2)溶解氧化时,产生Fe3+,加入Cu2(OH)2CO3调节混合液pH,其优点是:调节溶液的酸碱性,不引入杂质,使Fe3+全部转化为Fe(OH)3沉淀等;
(3)①当氯离子已沉淀完全,多加入一滴AgNO3溶液时,Ag+和![]() 开始结合,出现砖红色沉淀,故答案为:当加入最后一滴AgNO3溶液时,出现砖红色沉淀;
开始结合,出现砖红色沉淀,故答案为:当加入最后一滴AgNO3溶液时,出现砖红色沉淀;
②0.4470g氯氧化铜Cl-离子的物质的量:n(Cl-)=n(AgNO3)=0.1000mol·L-1×0.02L=0.002mol根据题意:2Cu2+~I2~2Na2S2O3 则0.2235g氯氧化铜固体中:n(Cu2+)=n(Na2S2O3)=0.2000mol·L-1×0.01L=0.002mol可知0.4470g氯氧化铜中含有:n(CuCl2)=0.001mol,n(CuO)=0.003mol,根据质量守恒有n(H2O)=(0.4470g-0.001mol×135g·mol-1-0.003mol×80g·mol-1)÷18g·mol-1=0.004mol,n(CuO)∶n(CuCl2)∶n(H2O)=3∶1∶4,则晶体的化学式为3CuO·CuCl2·4H2O,故答案为:3CuO·CuCl2·4H2O。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 LB.13.44 LC.3.36 LD.5.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
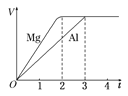
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯可用于预防或治疗破骨细胞活性异常导致的疾病,其结构简式为![]() ,在一定条件下可以发生如下转化:
,在一定条件下可以发生如下转化:
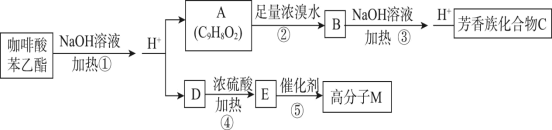
请回答以下问题:
(1)A的结构简式为________,E中官能团的结构简式为________。
(2)反应①~⑤中,属于取代反应的是________。
(3)④的化学反应方程式为_______;⑤的化学反应方程式为_______。
(4)由两分子C形成的六元环酯的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原予的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:
(1) A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为_________(用元素符号表示)。
(2) A与HF相比,其熔、沸点较低,原因是___________。
(3) B分子属于________(填“极性”或“非极性”)分子。
(4) D分子中心原子的杂化方式是________,由该原子组成的单质分子中包含________个π键,与该单质分子互为等电子体的常见分子的分子式为________。
(5) [Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请画出[Fe(NO)(H2O)5]2+结构示意图:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
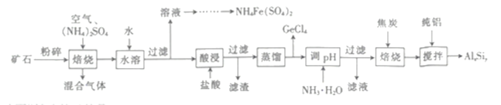
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________。
②“混合气体”的主要成分是_______________ (填化学式).
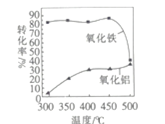
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________。
(3)GeCl4的佛点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________。
(5)假设流程中SiO2 损失了20%,Al2O3 损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com