
【题目】中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氣燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。 下列说法正确的是( )
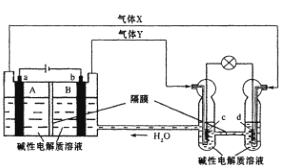
A. B区的OH-通过隔膜向a电极移动,A 区pH增大
B. 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C. c是正极,电极上的电极反应为2H++2e-=H2↑
D. 当有lmol电子转移时,b电极产生气体Y的体积为11.2L
【答案】B
【解析】
试题分析:依据图示知左边装置是电解池,右边装置是原电池,ab电极是电解池的电极,由电源判断a为阳极产生的气体是氧气,b为阴极产生的气体是氢气;cd电极是原电池的正负极,c是负极,d是正极;电解池中的电极反应为:a电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;b电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;原电池中是碱性溶液,电极反应为:c为负极失电子发生氧化反应:2H2-4e-+4OH-=2H2O;d电极为正极得到电子发生还原反应:O2+2H2O+4e-=4OH-,则A.a为阳极,电解时阴离子向阳极移动,发生4OH--4e-=2H2O+O2↑,促进水的电离生成H+,pH减小,A错误;B.图中右管中的OH-通过隔膜向负极移动,即向c电极移动,d为正极,发生还原反应,B正确;C.电解质溶液呈碱性,电极方程式应为2H2-4e-+4OH-=2H2O ,C错误;D.b为阴极,当有1mol电子转移时生成0.5mol氢气,但气体存在的条件未知,不能确定体积大小,D错误,答案选B。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入2mol A和1mol B,发生反应2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
xC(g),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x的值为 ( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A. Na与水反应时增大水的用量
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大反应容器体积
D. Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
A.气体的平均分子量不再变化 B.反应的平衡常数不变
C.(H2) = 2 (HI) D.气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
A.c1:c2=3:1
B.平衡时.Y和Z的生成速率之比为2:3
C.X、Y的转化率不相等
D.c1的取值范围为0mol/L<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJmol﹣1;
②2A→A﹣A△H=﹣b kJmol﹣1;
③E+A→A﹣E△H=﹣c kJmol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g)△H=﹣a kJmol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
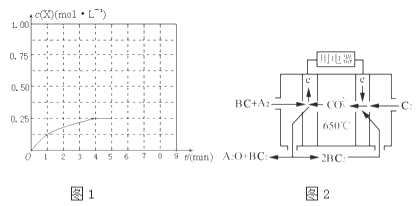
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法错误的是( )
物质(括号内为杂质) | 除杂方法 | |
A | CO2(O2) | 灼热的铜网 |
B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
C | CaCl2溶液(盐酸) | 加入过量CaCO3 , 过滤 |
D | CO2(CO) | 通入O2 点燃 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com