
【题目】碳酸钠俗名纯碱或苏打,在外观上与食盐相似,可用于洗涤,如清洗厨房用具的油污等。请你至少用两种方法区分厨房中用的食盐与纯碱__________。
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E和F表示含有10个电子的微粒,请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______;(填离子符号)
(2)D是由两种元素组成的分子,其水溶液呈碱性,D的结构式是_______________;
(3)向含B微粒溶液中加入含F微粒溶液,先出现白色沉淀,继续加入含F微粒溶液沉淀溶解,写出该过程的离子方程式__________________________________
(4)向含E微粒溶液中加入含F微粒溶液,并加热生成 C和D,写出该离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
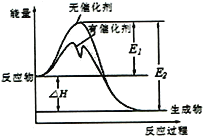
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-2akJ·mol-1
2SO3(g) ΔH =-2akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2═CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
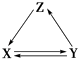
A.②③
B.③④
C.②④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入2.5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60Ml
B.240mL
C.30mL
D.120mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁轨道焊接常用到铝热反应,某学习小组进行铝热反应实验,装置如图所示。
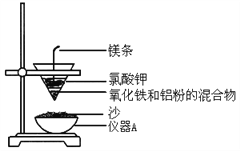
(1)仪器 A 的名称为_______。
(2)写出工业上制取金属镁的化学方程式______。
(3)点燃镁条引发反应,在反应过程中没有涉及到的化学反应类型是_______。
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(4)写出该铝热反应的化学方程式,并用单线桥表示电子转移的方向和数目_______。
(5)铝热反应中放出大量的热,有黑色熔融物落入沙中。学习小组推测黑色熔融物中除了含有铁和氧化铝,还含有铝和氧化铁,实验验证如下:
Ⅰ. 向冷却后的黑色固体中加入 NaOH 溶液,观察到有气体产生。实验结论:黑色固体中含有铝。写出该反应的离子方程式:________。
Ⅱ. 取少量黑色固体于试管中,加入稀盐酸,固体溶解,有气泡产生。向所得溶液中滴入几滴 0.01 mol·L- 1 KSCN 溶液,溶液不变色。实验结论:黑色固体中不含氧化铁。
你认为实验结论是否合理?____(填“合理”或“不合理”)。理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的_____极,OH—向______(填“正”或“负”)极作定向移动,Y极的电极反应方程式为________,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是_______ L。
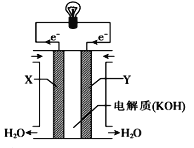
(2)为了验证Fe3 +与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是__________。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.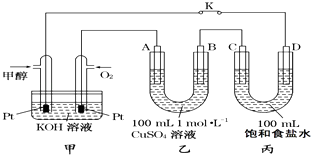
(1)甲中负极的电极反应式为 .
(2)乙中A极电极反应式为 , A极析出的气体在标准状况下的体积为 .
(3)丙装置溶液中C极的质量变化为 . 若在丙装置溶液中滴入酚酞溶液进行上述实验,D极附近能观察到的实验现象: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com