
【题目】如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.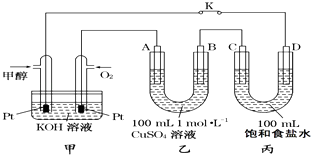
(1)甲中负极的电极反应式为 .
(2)乙中A极电极反应式为 , A极析出的气体在标准状况下的体积为 .
(3)丙装置溶液中C极的质量变化为 . 若在丙装置溶液中滴入酚酞溶液进行上述实验,D极附近能观察到的实验现象: .
【答案】
(1)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
(2)4OH﹣﹣4e﹣=2H2O+O2↑;2.24L
(3)12.8g;有气泡产生,D极附近溶液变红
【解析】解:(1.)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,所以答案是:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
(2.)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为x,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2+ | = | 2e﹣ | = | Cu | |||||
0.1mol | 0.2mol | ||||||||
2H+ | + | 2e﹣ | = | H2↑ | |||||
2x | x | ||||||||
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH﹣ | - | 4e﹣ | = | 2H2O | + | O2↑ |
4x | x |
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;2.24L;
(3.)C极与正极相连为阳极,Cu在阳极失电子生成铜离子,甲电池中消耗0.1mol氧气,转移电子为0.4mol,则丙中也转移0.4mol电子,由Cu﹣2e﹣=Cu2+可知参加反应的Cu为0.2mol,器质量为12.8g,即C极的质量变化为;D极为阴极,阴极上水得电子生成氢气和氢氧根离子,所以滴入酚酞溶液D极附近溶液变红;
所以答案是:12.8g;有气泡产生,D极附近溶液变红.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】碳酸钠俗名纯碱或苏打,在外观上与食盐相似,可用于洗涤,如清洗厨房用具的油污等。请你至少用两种方法区分厨房中用的食盐与纯碱__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是 ( )

A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.pH试纸变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用激光照射硫酸铜溶液可以观察到丁达尔现象
B.钠与氧气反应的产物与反应条件无关
C.燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
D.利用氯气单质的氧化性可以把碘离子转化为碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比2∶4∶1∶1共存于同一溶液中,那么M可能是( )
A. Na+ B. OH- C. Cl- D. CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化物在工业生产、日常生活中应用都非常广泛.某学习小组为探究一些实用性很强的氯化物,进行了一系列的资料查询与具体实验.
(1)用于制造电池的原材料二氯亚砜(SOCl2),是一种液态化合物,沸点为77℃.在盛10mL水的锥形瓶中小心滴加8~10滴SOCl2可观察到剧烈反应,液面上形成白雾,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤纸褪色.轻轻振荡锥形瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出.室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88kJ.根据以上实验,写出SOCl2与水反应的热化学方程式 .
(2)低温蒸干AlCl3溶液得到固体的主要成分是;小组某同学想制取无水AlCl3固体,他提出可以用AlCl36H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因 .
(3)TiO2是一种非常好的催化剂.某同学通过查阅资料显示:TiCl4水解程度很大,可以用于TiO2的制备,制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2xH2O经焙烧得TiO2 . 请写出TiCl4水解的化学方程式
(4)某同学利用NaCl溶液设计实验验证Fe在原电池反应中的生成物,使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,实验结束后,该同学往Fe电极区滴入2滴黄色铁氰化钾溶液,现象是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( ) 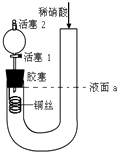
A.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
B.关闭活塞1,加入稀硝酸至液面a处
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:
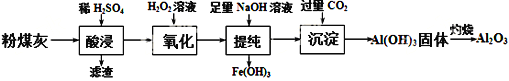
(1) “酸浸”时需加入过量的稀硫酸,写出Al2O3溶解的离子方程式___________________。
(2)证明酸浸后溶液中存在Fe3+的方法是:取酸浸后的溶液少许置于试管中,向其中滴加硫氰化钾溶液,溶液变为血红色;再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去,继续滴加会有气泡逸出,该气体会使带火星的木条复燃。
①红色变深的原因是(用离子方程式表示):_____________________________;
②溶液红色褪去是由于过氧化氢氧化了硫氰根离子,已知双氧水氧化SCN—生成N2、CO2和SO42-,写出该反应的离子方程式:____________________________;
③有气体逸出,说明Fe3+对H2O2的分解有催化作用,写出催化过程第一步反应的离子方程式________________________________。

(3) “提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=___________。将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为______________。
(4) “沉淀”过程中,通入过量CO2时发生反应的化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com