
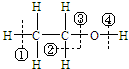
 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A、乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
| B、乙醇与钠反应,在④位置断裂 |
| C、乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应 |
| D、乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 |
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 170℃ |


科目:高中化学 来源: 题型:
| A、霾的形成与PM2.5有直接关系 |
| B、自行车钢架生锈主要是电化学腐蚀所致 |
| C、用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 |
| D、人类在研究物质微观结构的过程中,扫描隧道显微镜、光学显微镜、电子显微镜先后得到了使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 |
| B、ClO-+H2O+CO2→HClO+HCO3- |
| C、2ClO-+SO2+H2O→2HClO+SO32- |
| D、等体积、等物质的量浓度的HClO 和Na2CO3混合后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6种 |
| B、7 种 |
| C、8 种 |
| D、9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、CO32-、Cl- |
| B、K+、NH4+、HCO3-、OH- |
| C、H+、Fe2+、ClO-、SO42- |
| D、Na+、Ba2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com