
【题目】有关下列电化学装置的说法中正确的是( )
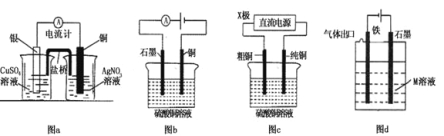
A.图a是原电池装置,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法不正确的是

A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为0.02 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2 mol氨气,下列说法正确的是
A. 质量为17 g
B. 含有6.02×![]() 个NH3分子
个NH3分子
C. 标准状况下的体积为44.8 L
D. 溶于1 L水后,溶液中NH4+的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
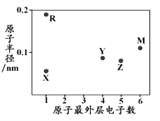
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g) + Cl2(g)![]() SO2Cl2(l) △H = -97.3 kJ/mol;
SO2Cl2(l) △H = -97.3 kJ/mol;
② 硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内画出所缺装置,并注明相关试剂的名称。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_____________,分离产物的方法是(填字母)_________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计 一个简单实验验证二者是否恰好完全反应: (简要描述实验步骤、现象和结论)。
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是 ( )
①0.5 mol氨气 ②4 g氦气 ③4 ℃时9 mL水 ④0.2 molH3PO4
A. ④③②① B. ①④③② C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; ![]() 在分析试剂、医药、电子工业中用途广泛
在分析试剂、医药、电子工业中用途广泛![]() 请回答下列问题:
请回答下列问题:
(1)![]() 可作净水剂,其原理是 ______
可作净水剂,其原理是 ______ ![]() 用必要的化学用语和相关文字说明
用必要的化学用语和相关文字说明![]() .
.
(2)相同条件下, ![]() 的
的![]() 中
中![]() ______
______ ![]() 填“等于”、“大于”或“小于”
填“等于”、“大于”或“小于”![]() 中
中![]()
(3)均为![]() 的几种电解质溶液的pH随温度变化的曲线如图1所示.
的几种电解质溶液的pH随温度变化的曲线如图1所示.
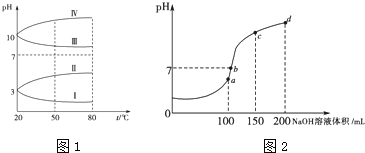
①其中符合![]()
![]() 的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
②![]() 时,
时, ![]() 的
的![]()
![]() 中
中![]() ___ mol/L
___ mol/L
(4)室温时,向100mL![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com