
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g) + Cl2(g)![]() SO2Cl2(l) △H = -97.3 kJ/mol;
SO2Cl2(l) △H = -97.3 kJ/mol;
② 硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内画出所缺装置,并注明相关试剂的名称。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_____________,分离产物的方法是(填字母)_________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计 一个简单实验验证二者是否恰好完全反应: (简要描述实验步骤、现象和结论)。
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
【答案】(1)饱和食盐水 催化剂 (2)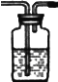 (浓硫酸)
(浓硫酸)
(3)2ClSO3H ![]() SO2Cl2 + H2SO4 C (4)①②③
SO2Cl2 + H2SO4 C (4)①②③
(5)取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色,则二者未恰好完全反应;若不褪色,则二者恰好完全反应。
【解析】
试题分析:(1)根据题意,装置甲为储气装置,用于提供氯气,仪器A用于将氯气由甲装置排入乙装置,,所以氯气在仪器A中盛放的试剂中溶解度要小,以减少损失,则仪器A中盛放的试剂为饱和食盐水;根据化学反应SO2(g) + Cl2(g)![]() SO2Cl2(l),从实验装置丙中可以看出,活性炭没参加反应,只能是作催化剂。
SO2Cl2(l),从实验装置丙中可以看出,活性炭没参加反应,只能是作催化剂。
(2)因为硫酰氯在潮湿空气中“发烟”,所以制备硫酰氯的氯气必须是干燥的,所以乙装置为干燥装置,用浓硫酸干燥氯气,所以答案为 (浓硫酸)
(浓硫酸)
(3)根据题意,ClSO3H→SO2Cl2,ClSO3H的系数为2,根据反应前后原子个数守恒,差2个H、1个S、4个O,即H2SO4,所以反应的化学方程式为2ClSO3H ![]() SO2Cl2 + H2SO4,SO2Cl2为液体,沸点比较低,H2SO4为液体,沸点较高,它们不分层,可以利用沸点不同进行蒸馏分离,答案选C。
SO2Cl2 + H2SO4,SO2Cl2为液体,沸点比较低,H2SO4为液体,沸点较高,它们不分层,可以利用沸点不同进行蒸馏分离,答案选C。
(4)Cl2具有氧化性,SO2以还原性为主,SO2+Cl2+2H2O=H2SO4+2HCl,提高产率可以采取措施:控制气流速率,宜慢不宜块;若三颈烧瓶发烫,可适当降温;先通冷凝水,冷凝回流副产物和产品,再进行实验,答案选①②③。
(5)SO2和Cl2恰好反应生成硫酸和盐酸,若SO2或Cl2剩余,SO2和氯气均能使品红溶液褪色,所以取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色,则二者未恰好完全反应;若不褪色,则二者恰好完全反应。


科目:高中化学 来源: 题型:
【题目】Ⅰ、选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.升华法
(1)______________分离饱和食盐水与沙子的混合物。
(2)______________分离水和汽油的混合物。
(3)______________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)_____________从碘的水溶液里提取碘。
Ⅱ、蒸馏是实验室制备蒸馏水的常用方法。
(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的错误是_____________________。
(2)仪器A的名称是______________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量________________,其作用是________________________________________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
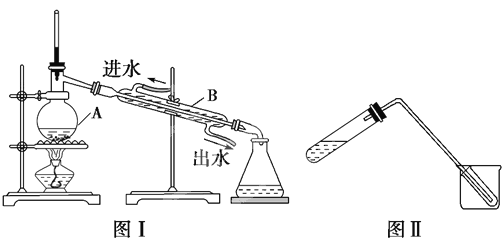
【题目】如图装置中,溶液体积均为200 ml ,开始时,电解质溶液的浓度均为0.1 mol·L-1 ,工作一段时间后,测得导线上通过了0.02 mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
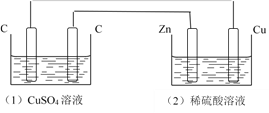
A. (1)、(2)两装置均为电解池
B. (1)、(2)溶液的PH均减小
C. (1)中阳极电极反应式为:4OH--4e-===2H2O+O2↑
D. (1)中阴极上析出0.32 g Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,意大利物理学家伏特把一块锌板和一块锡板浸在盐水里,发现连接两块金属板的导线中有电流通过。下列说法正确的是( )
A.锌板是正极
B.锡板被氧化
C.盐水是电解质溶液
D.电子由锡板沿导线流向锌板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列电化学装置的说法中正确的是( )
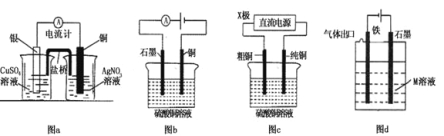
A.图a是原电池装置,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) H=___________kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+ 6H2(g) ![]() CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
① 该反应平衡常数表达式K=_______________。
② 已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示,该反应的H________0 (填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将_____(填“增大”、“减小”或“不变”)。
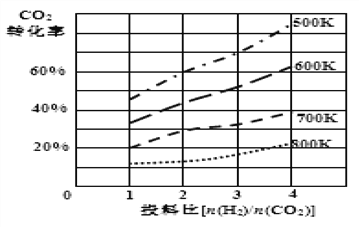
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能证明上述可逆反应达到平衡的量是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
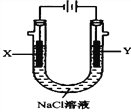
请写出电解过程中Y电极附近观察到的现象:______________,当燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH=________(假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星──土卫六。科学家对探测器发回的数据进了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的叙述正确的是 ( )
A. 碳氢化合物的通式为CnH2n+2 B. 石油的主要成分是碳氢化合物
C. 乙炔是含碳量最高的碳氢氧化物 D. 碳氢氧化物中的化学键都是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂和糖类共性的叙述中不正确的是 ( )
A. 都是人类生命活动的物质基础
B. 一定都是混合物
C. 组成元素一般都是C、H、O
D. 前者全部是小分子,后者部分是大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在在生活生产中有着重要应用.
(1)粗制![]() 晶体中常含有杂质
晶体中常含有杂质![]() .
.
①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是 ______ .
,下列物质最好选用的是 ______ .
A. ![]()
![]()
![]() 氯水
氯水![]()
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的 ______ .
,调整溶液pH可选用下列中的 ______ .
A.NaOH ![]()
![]()
![]()
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,先生成 ______ 沉淀
混合溶液中逐滴加入氨水,先生成 ______ 沉淀![]() 填化学式
填化学式![]() ,生成该沉淀的离子方程式为 ______
,生成该沉淀的离子方程式为 ______ ![]() 已知
已知![]() 时
时![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]() ______
______ ![]()
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是 ______ ,产生该现象的原因是
可以观察到的现象是 ______ ,产生该现象的原因是![]() 用离子方程式表示
用离子方程式表示![]() ______ 已知:Ksp[
______ 已知:Ksp[![]() ]=4.0x10-38。
]=4.0x10-38。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com