
【题目】现有下列八种物质:①铝 ②![]() 溶液 ③蔗糖固体 ④稀硫酸 ⑤熔融的
溶液 ③蔗糖固体 ④稀硫酸 ⑤熔融的![]() ⑥
⑥![]() 饱和溶液 ⑦
饱和溶液 ⑦![]() ⑧新制备的氢氧化铁胶体分散系
⑧新制备的氢氧化铁胶体分散系
(1)上述物质属于非电解质的有_________(填序号)。
(2)上述物质能导电且属于电解质的有_________(填序号)。
(3)若将⑥滴入下列物质中,能形成⑧的是_________(填字母代号)。
A.![]() 浓溶液 B.
浓溶液 B.![]() 浓溶液 C.冷水 D.沸水
浓溶液 C.冷水 D.沸水
(4)可利用哪种效应鉴别⑥和⑧:______________________。
(5)⑦和足量②反应的离子方程式为______________________。
(6)①与⑤的水溶液反应的离子方程式为______________________。
【答案】③⑦ ⑤ D 丁达尔效应 ![]()
![]()
【解析】
(1)电解质是指:在水溶液里或熔融状态下能导电的化合物,酸、碱、盐、部分有机物、金属氧化物都是电解质,单质、混合物不是电解质也不是非电解质,非金属氧化物,非金属氢化物,有机物属于非电解质;
(2)熔融态的碱或盐属于能导电的电解质;
(3)将饱和![]() 溶液滴入沸水,形成胶体;
溶液滴入沸水,形成胶体;
(4)区分溶液和胶体的方法称丁达尔效应;
(5)二氧化碳与足量氢氧化钡反应生成碳酸钡和水;
(6)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
①铝是金属,是单质,既不是电解质也不是非电解质,能导电;
②![]() 溶液是混合物,能导电,既不是电解质也不是非电解质;
溶液是混合物,能导电,既不是电解质也不是非电解质;
③蔗糖固体是有机物,不能导电,是非电解质;
④稀硫酸是混合物,能导电,既不是电解质,也不是非电解质;
⑤熔融的![]() ,能导电,是电解质;
,能导电,是电解质;
⑥![]() 饱和溶液是混合物,能导电,既不是电解质,也不是非电解质;
饱和溶液是混合物,能导电,既不是电解质,也不是非电解质;
⑦![]() 本身不能电离,属于非电解质;
本身不能电离,属于非电解质;
⑧新制备的氢氧化铁胶体分散系属于混合物,既不是电解质也不是非电解质,能导电;
(1)属于非电解质的是蔗糖固体、二氧化碳;
(2)能导电属于电解质的是熔融的氢氧化钠;
(3)将饱和三氯化铁溶液加入到沸水中制得氢氧化铁胶体;
(4)区别溶液和胶体的方法是丁达尔效应,在一束光照射时,溶液没有现象,胶体会产生光亮的通路,可以区分溶液和胶体;
(5)二氧化碳与足量氢氧化钡反应生成碳酸钡和水,离子反应为![]() ;
;
(6)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应为![]() ;
;


科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机金属化合物的应用研究是目前科学研究的前沿之一。二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
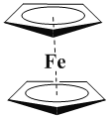

环戊二烯二茂铁
(1)环戊二烯分子中σ键和π键的个数比为___。
(2)下列关于环戊二烯和二茂铁的说法不正确的是__(填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___。
(4)已知环戊二烯阴离子(C5H5-)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___(填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:
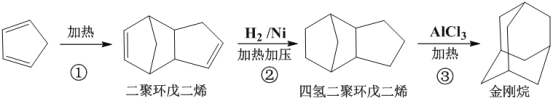
①金刚烷的分子式为____,反应①的反应类型是___。
②金刚烷的二氯代物有__种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出符合下列条件的二聚环戊二烯的同分异构体的结构简式___。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
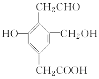
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾![]() 和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为
和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为![]() 。
。
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)![]() 是_______(“氧化”或“还原”)产物;产生
是_______(“氧化”或“还原”)产物;产生![]() ,则转移电子的物质的量为____mol。
,则转移电子的物质的量为____mol。
(3)从铬元素![]() 的化合价态上判断,
的化合价态上判断,![]() 三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
(4)已知氯气有毒,与水反应生成两种酸。实验室制备氯气可选用__________溶液进行尾气处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确书写下列反应的化学方程式或离子方程式。
(1)将少量的SO2气体通入足量澄清石灰水中的离子方程式:___。
(2)将过量的SO2气体通入少量氨水中的离子方程式:___。
(3)过量的铁与稀硝酸反应的离子方程式为___,该反应中稀硝酸体现___性。
(4)碳与浓硝酸反应的化学方程式为___,该反应中浓硝酸体现___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
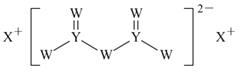
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com