
����Ŀ����ʹ������к͵ζ����ⶨ���۰״������� (g/100mL )��
I��ʵ�鲽�裺
(1)��_____ (���������� )��ȡ10.00mL ʳ�ð״ף���_____ (���������� )����ˮϡ�ͺ�ת�Ƶ�100mL_____ (���������� )�ж��ݣ�ҡ�ȼ��ô���״���Һ��
(2)��_____ɫ�ֱ��ζ���ȡ����״���Һ 20.00mL ����ƿ�У������еμ�2��_____��Ϊָʾ����
(3)��ȡʢװ0.1000mol/L NaOH ��Һ�ĵζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ ���ʱ�Ķ���Ϊ_____mL��
![]()
(4)�ζ�����_____ʱ��ֹͣ�ζ�������¼ NaOH��Һ���ն������ظ��ζ� 3 �Ρ�
II��ʵ���¼
�ζ����� ʵ������ (mL ) | 1 | 2 | 3 | 4 |
V (��Ʒ ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (���� ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)��ͬѧ�ڴ�������ʱ�����ƽ�����ĵ�NaOH��Һ�����Ϊ��V�� (15.95+15.00+15.05+14.95 )/4��15.24(mL)��ָ�����ļ���IJ�����֮����_____�� ����ȷ���ݴ������ɵ�c (���۰״�)��_____mol/L��
(6)�ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����_____ (��д���)
a��ʢװNaOH�ĵζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b��ʢװ����״ĵζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
���𰸡���ʽ�ζ��� �ձ� ����ƿ �� ��̪ 0.60 ��Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ ��1�εζ��������ƫ�����쳣ֵ��Ӧ��ȥ 0.075 ab
��������
(1 )������ȡҺ������ľ�ȷ���Լ�Һ�������ѡ����������Һ�Ķ����ڶ�Ӧ���������ƿ�н��У�
(2 )��ɫ�ֱ��ĵζ���Ϊ��ʽ�ζ��ܣ���ɫ�ֱ��ĵζ���Ϊ��ʽ�ζ��ܣ�����������������Һǡ�÷�Ӧʱ���ɴ����ƣ���Һ�ʼ��ԣ����÷�̪��ָʾ����
(3 )���ݵζ��ܵĽṹ�뾫ȷ����������
(4 )��ǰΪ��ɫ���ζ�������Ϊdz��ɫ���ݴ��жϵζ��յ�����
(5 )�������ݵĺ��������ƽ�����ĵ�NaOH��Һ�������Ȼ����ݰ״���NaOH ��Һ��Ӧ�Ĺ�ϵʽ��CH3COOOH��NaOH�����
(6 )����c (���� )��![]() ��������������V (�� )��Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V (�� )��Ӱ�죬�Դ��ж�Ũ�ȵ���
(1 )��ʽ�ζ��ܾ�ȷ��Ϊ0.01ml��Ӧѡ����ʽ�ζ�����ȡ�״ף�����ʽ�ζ�����10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
�ʴ�Ϊ����ʽ�ζ��ܣ��ձ�������ƿ��
(2 )��������ԣ���Ҫ�ú�ɫ�ֱ��ĵζ��� (��ʽ�ζ��� )��ȡ��
���ڴ�������Һ��ʾ���ԣ����÷�̪��ָʾ����������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪���ʴ�Ϊ���죻��̪��
(3 )����ͼʾ��֪���ζ���Һ��Ķ���0.60mL���ʴ�Ϊ��0.60��
(4 )NaOH�ζ�ʳ��ʱ���ζ�����ǰΪ��ɫ���ζ�������Ϊdz��ɫ����ζ��յ�����Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
�ʴ�Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
(5 )��1�εζ�������Դ����쳣ֵ��Ӧ��ȥ��3������NaOH��Һ�����Ϊ��15.00mL��15.05mL��14.95mL����NaOH��Һ��ƽ�����Ϊ15.00mL�����ݹ�ϵʽCH3COOOH��NaOH��֪��n (CH3COOOH )��n (NaOH )��0.1000mol/L��0.015L��0.0015mol��c (���۰״� )��![]() ��0.075molL��1��
��0.075molL��1��
�ʴ�Ϊ����һ��������Դ����쳣ֵ��Ӧ��ȥ�� 0.075��
(6 )a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ����ҺŨ�Ƚ��ͣ����V (�� )ƫ�ⶨ��ҺŨ��ƫ�ߣ���a��ȷ��
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V (�� )ƫ����ҺŨ��ƫ�ߣ���b��ȷ��
c����ƿ�м������״���Һ���ټ�����ˮ����V (�� )��Ӱ�죬��ҺŨ�Ȳ��䣬��c����
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��������Һ�����ʵ����ʵ���ƫС�����V (�� )ƫС����ҺŨ��ƫ�ͣ���d����
�ʴ�Ϊ��ab��


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������ˮ����װ��ģ��ϸ���������IJ������̣��ɽ������л���ˮ�Ļ�ѧ��ֱ��ת��Ϊ���ܡ�����˵���в���ȷ����
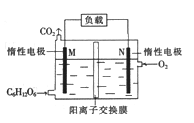
A. M��������������������Ӧ
B. ��������:M�����ء�N���������Һ��M
C. N���ĵ缫��Ӧ:O2+4H++4e-=2H2O
D. ��N������5.6L(�����)����ʱ�������NA��H+ͨ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ����������(�������������黯����)���³����������о���ȡ������Ҫ�ɹ������о���Ŀ�ٻ�2013�����������Ȼ��ѧ����һ�Ƚ���
��1����̬Fe2+�ĺ�������Ų�ʽΪ_________________��
��2����������������Ԫ���е縺��ֵ�ɴ�С��˳����__________(����Ӧ��Ԫ�ط������)��
��3��Fe(SCN)3��Һ�м���NH4F���������·�Ӧ��Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN��
��(NH4)3FeF6���ڵ����������������ۼ����_________(ѡ����ţ���ͬ)��
a����λ�� b����� c�������� d�����Ӽ�
����֪SCNһ�и�ԭ������������8�����ȶ��ṹ����Cԭ�ӵ��ӻ���ʽΪ_____________,��ԭ������![]() ����
����![]() �����ı�ֵΪ___________________��
�����ı�ֵΪ___________________��
��4��FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ�����������FeF3�����۵����1000�����Խ������ֻ������۵����ϴ��ԭ��_______________________________��
��5�������ס�����Ϊͬ����Ԫ�أ����仯����Ľṹ�������Ƕ������ġ�
�������⻯��RH3(NH3��PH3��AsH3)��ij��������R�ĺ˵�����ı仯��������ͼ��ʾ����Y��ɱ�ʾ���⻯��(RH3)���ʿ�����________��
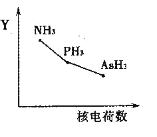
a���ȶ��� b���е� c��R��H���� d�����Ӽ�������
��̼�����ѻ���������������ͺ��պ���������й㷺��Ӧ�ã���ṹ����̼ԭ��ȡ�������Ѿ���(�ṹ��ͼ)����ĵ�ԭ�ӣ��ݴ˷���������̼�����ѻ�̨��Ļ�ѧʽΪ______��
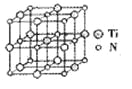
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������ȷ���� (���� )
A.��ϩ�����ʽ C2H4B.��Ȳ�Ľṹ��ʽ CHCH
C.���Ȼ�̼�ĵ���ʽ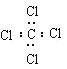 D.����ı���ģ��
D.����ı���ģ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѽ�IJ����м��顢���顢��ϩ����ϩ 4 �����壬��������ȫ�ֽ�ʱ�������ѽ�����ƽ��ʽ��Ϊ (���� )
A.58B.43.5C.29D.14.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ���պû�ѧ������ѧ�û�ѧ�Ļ����������йر�����ȷ������ ��
A�����ԭ�ӽṹʾ��ͼ�� 
B��NH4Br�ĵ���ʽ��
C��������Ϊ20���ԭ�ӣ�![]() Ar
Ar
D��Be2+�е��������͵�����֮��Ϊ��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���û���ƽ���Ϊ��(N2H4)��������(H2O2)���������һ������ѺϽ���ϡ���ش��������⣺
��1��NH3��H2O2�����е縺������Ԫ�������ڱ��е�λ��Ϊ___����һ����������Ԫ��Ϊ___��
��2������ԭ������Ϊ24�����̬�����Ų�ʽΪ___��
��3��1molN2H4�����к��е�������ĿΪ___��
��4��H2O2���ӽṹ��ͼ1��������ԭ���ӻ��������Ϊ___��������������CS2����Ҫ˵��ԭ��___��
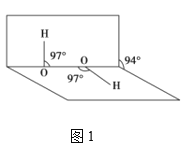
��5����������ͼ2��ʾ�����ھ��������ϵ�ԭ�ӵ���λ��Ϊ___����������������ܶ�Ϊ��gcm-3�������ӵ�����ΪNA�����������Nԭ�Ӽ�ľ���Ϊ___cm��
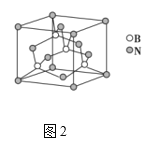
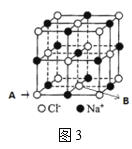
��6����ͼ3��ʾ������A�����Ƶ����������ģ���B�����Ƶ���___����㣬���Ļ����ģ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱCuSO4���ܽ����Sg���䱥����Һ�ܶ�Ϊdg��cm��3�����ʵ���Ũ��Ϊcmol��L��1��������������Һ�м���mg��ˮCuSO4��������ngˮ��ָ�t�������ܻ��Wg�������壬���й�ϵʽ��ȷ����
A. c��![]() mol��L��1 B. S��
mol��L��1 B. S��![]() g
g
C. m��![]() g D. W��
g D. W��![]() g
g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
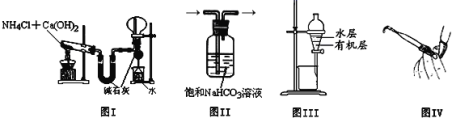
A.ͼI����ʵ�����ư������ռ�����İ���
B.ͼII���ڳ�ȥCl2�к��е�����HCl
C.ͼIII������ȡI2��CCl4��Һ�е�I2
D.ͼIV���ڼ���ʽ�ζ����Ƿ�©Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com