
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数.
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量.重复操作,计算.仪器a的名称是;其中发生反应的化学方程式为 . 实验中为保证NaHCO3分解完全需加热至恒重,判断方法是 .
(2)方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,待沉淀后,过滤,洗涤,干燥,称量固体质量,计算.
写出NaHCO3与足量Ba(OH)2溶液反应的离子方程式;实验中判断沉淀是否完全的方法是 . 过滤操作中,除烧杯、漏斗外,还要用到的玻璃仪器为 .
(3)方案三:称取一定质量样品,按如图装置进行实验: 
B装置内所盛试剂是;D装置的作用是
实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为 .
某同学认为上述测定结果(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是 .
【答案】
(1)坩埚;2NaHCO3 ![]() Na2CO3+H2O+CO2↑;两次称量的误差不超过0.1g为止
Na2CO3+H2O+CO2↑;两次称量的误差不超过0.1g为止
(2)HCO3﹣+OH﹣+Ba2+=BaCO3↓+H2O;取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全;玻璃棒
(3)浓硫酸;防止空气中的水蒸气、二氧化碳进入C装置;70.4%;偏低;缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置
【解析】解:(1)[方案一]称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量.重复操作,计算.仪器a的名称是坩埚,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑,实验中为保证NaHCO3分解完全需加热至恒重判断方法是两次称量的误差不超过0.1g为止,
Na2CO3+H2O+CO2↑,实验中为保证NaHCO3分解完全需加热至恒重判断方法是两次称量的误差不超过0.1g为止,
所以答案是:坩埚;2NaHCO3 ![]() Na2CO3+H2O+CO2↑;两次称量的误差不超过0.1g为止;(2)[方案二]碳酸氢钠和足量氢氧化钡混合反应,碳酸氢钠全部反应,化学式钱系数为1,据此配平书写离子方程式为:HCO3﹣+OH﹣+Ba2+=BaCO3↓+H2O,实验中判断沉淀是否完全的方法是:可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,过滤时需用玻璃棒引流,
Na2CO3+H2O+CO2↑;两次称量的误差不超过0.1g为止;(2)[方案二]碳酸氢钠和足量氢氧化钡混合反应,碳酸氢钠全部反应,化学式钱系数为1,据此配平书写离子方程式为:HCO3﹣+OH﹣+Ba2+=BaCO3↓+H2O,实验中判断沉淀是否完全的方法是:可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,过滤时需用玻璃棒引流,
所以答案是:HCO3﹣+OH﹣+Ba2+=BaCO3↓+H2O;取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全;玻璃棒;(3)[方案三]B中为浓硫酸吸收水,干燥二氧化碳,空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性,
设Na2CO3和NaHCO3的物质的量分别为x、y,则
Na2CO3 | +H2SO4=H2O+ | CO2↑ | +Na2SO4 |
1 | 1 | ||
x | x |
2NaHCO3 | +H2SO4= Na2SO4+2H2O+ | 2CO2↑ |
2 | 2 | |
y | y |
106x+84y=17.90
44x+44y=8.80
解得x=0.05mol
y=0.15mol
则样品中NaHCO3的质量分数为= ![]() ×100%=70.4%,
×100%=70.4%,
实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,导致测定二氧化碳足量减小,计算得到碳酸氢钠的物质的量减小,测定结果偏低,所以需设计一个装置将A、B中的CO2全部吹入C中吸收,
所以答案是:浓硫酸;防止空气中的水蒸气、二氧化碳进入C装置;70.4%;偏低;缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置.


科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示: 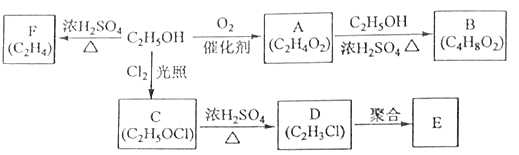
回答下列问题:
(1)D中官能团的名称为 .
(2)A转化成B的化学方程式是 . 比B多一个碳原子的B的同系物有种同分异构体.
(3)由乙醇生产C的化学反应类型为 .
(4)E是一种常见的塑料,其化学名称是 . D在一定条件下可发生消去反应,写出反应的化学方程式: .
(5)由乙醇生成F的化学方程式为 .
(6)分子式为C5H8的一种同分异构体是合成天然橡胶的单体,写出其聚合成天然橡胶的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.NaHCO3溶液与醋酸:CO ![]() +2CH3COOH═2CH3COO﹣+H2O+CO2↑
+2CH3COOH═2CH3COO﹣+H2O+CO2↑
B.碳酸氢铵溶液与足量NaOH溶液:HCO3﹣+OH﹣═H2O+CO ![]()
C.用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO﹣+H2O+CO2↑
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性:H++SO ![]() +Ba2++OH﹣═H2O+BaSO4↓
+Ba2++OH﹣═H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如图实验:
(1)操作Ⅰ的名称是 . 气体A是(填化学式).
(2)反应①的离子方程式是 .
(3)铁、铝的混合物中加入足量NaOH溶液,反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+ , 为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.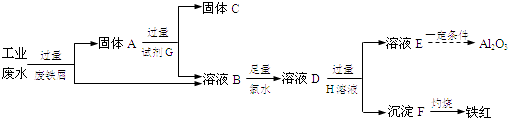
请回答:
(1)固体A的成分是(填化学式).
(2)溶液B中的金属阳离子有 .
(3)B→D反应的离子方程式是 .
(4)试剂G是(填名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则X离子可能为
所含离子 | NO3— | SO42— | H+ | X |
浓度mol/L | 2 | 1 | 2 | 1 |
A.Cl—B.Ba2+C.Fe2+D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的蒸汽完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的二氧化碳该有机物可能是( )
A.C2H6
B.C2H5OH
C.C2H4O
D.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.01mol/L CH3COOH溶液中c(H+)=4.32×10﹣4mol/L,则该CH3COOH 溶液中水的离子积常数( )
A.<1×10﹣14
B.>1×10﹣14
C.=1×10﹣14
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com