
【题目】向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
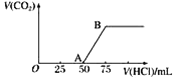
A. OA段所发生反应的离子方程式:H++OH-===H2O
B. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1
C. 产生的CO2体积(标准状况下)为0.056 L
D. 稀释液中NaOH的物质的量浓度为0.025 mol·L-1
【答案】A
【解析】
A.根据图像可知在A~B段发生反应:HCO3-+H+===H2O+CO2↑;则产生HCO3-的反应:CO32-+H+===HCO3-;二者反应消耗的酸的物质的量相等,由于气体达到最大消耗的盐酸是25 mL,则产生HCO3-的反应也消耗盐酸25 mL,因此在O~A段发生反应是H++OH-===H2O、CO32-+H+===HCO3-;故A分析错误;
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,根据消耗的HCl的物质的量的关系可知二者的物质的量的比是1∶1,由于溶质处于同一溶液,所以其物质的量浓度之比为1∶1,故B分析正确;
C.n(CO2)=n(HCl)=0.1mol·L-1×0.025L=0.0025mol,在标准状况下产生的CO2体积是V(CO2)= 0.0025 mol×22.4 L·mol-1=0.056 L,故C分析正确;
D.HCl+NaOH===NaCl+H2O,n(NaOH)=n(HCl)=0.1mol·L-1×0.025L=0.0025mol;c(NaOH)·V(NaOH)=n(NaOH)= 0.002 5 mol;c(NaOH)= 0.002 5 mol÷0.1 L=0.025 mol·L-1,故D分析正确;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 在医药合成中有着广泛的用途。下列而关该物质的说法正确的是
在医药合成中有着广泛的用途。下列而关该物质的说法正确的是
A. 该化含物中含氧官能团为酯基
B. 该化台物中的所有碳原子一定处于同一平面内
C. 该化合物可发生取代反应、加成反应和氧化反应
D. 该化合物的同分异构体中,苯环上有两个取代基的共3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A. 放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 放电时正极反应为FeO42-+4H2O+3e-===Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):
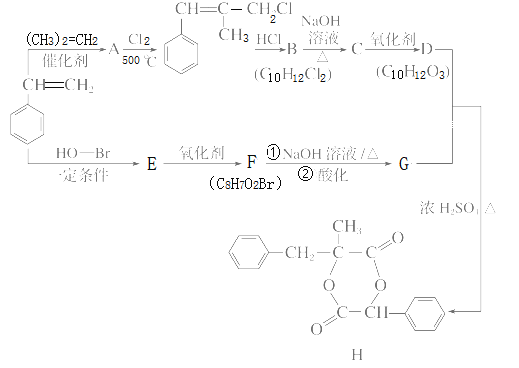
已知:①RCH==CH2+CH2==CHR′![]() CH2==CH2+RCH==CHR′;
CH2==CH2+RCH==CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2C==CH2的同分异构体中存在顺反异构的有机物的名称为________________。
(2)A的核磁共振氢谱除苯环上的H外,还显示______组峰,峰面积比为____。
(3)D分子中含有的含氧官能团名称是____________________________, E的结构简式为____________________________________________。
(4) D和G反应生成H的化学方程式为_____________________________________。
(5)G的同分异构体中,同时满足下列条件的有种(不包括立体异构)_____________。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“-O-”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3--丁二醇的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请回答下列问题:
(1)写出A元素的最高价氧化物的电子式_____________。
(2)B元素在周期表中的位置为_____________。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______________。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图____________。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式______________
(3)写出Y的价电子排布式_________________________。
(4)元素T与氯元素相比,非金属性较强的是_______(用元素符号表示),下列表述中能用于证明这一事实的是_______(填字母代号)。
A.气态氢化物的挥发性 B.两元素的电负性
C.含氧酸的酸性 D.氢化物中X—H键的键长(X代表T和Cl两种元素)
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O![]() Cl2+H2↑+2OH—
Cl2+H2↑+2OH—
B. CuC12溶液中加入氨水:Cu2++2OH- Cu(OH)2↓
C. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2 2I2+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com