
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A. 放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 放电时正极反应为FeO42-+4H2O+3e-===Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
【答案】C
【解析】
由反应可知,放电时Zn为负极,K2FeO4在正极上发生还原反应;充电时电池的正极与电源的正极相连为阳极,阳极发生氧化反应,据此答题。
A.放电时,负极Zn失电子被氧化,生成Zn(OH)2,电极反应式为Zn-2e-+2OH-═Zn(OH)2,故A正确;
B.K2FeO4为电池的正极,得电子发生还原反应,生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,故B正确;
C.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D.放电时,正极生成OH-,溶液碱性增强,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg/cm-3,质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A. 溶质的物质的量浓度c=1000a/35Vmol/L
B. 溶质的质量分数为ω=a /(Vρ-a)×100%
C. 溶液中c(OH-)=1000b/Vmol/L+c(H+)
D. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
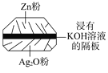
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
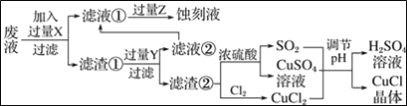
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X_______,Y________
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_________________;生产过程中调节溶液的pH不能过大的原因是__
(3)写出产生CuCl的化学方程式:__________________________________
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
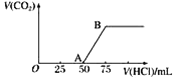
A. OA段所发生反应的离子方程式:H++OH-===H2O
B. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1
C. 产生的CO2体积(标准状况下)为0.056 L
D. 稀释液中NaOH的物质的量浓度为0.025 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Cu2+、K+、SO42-、NO3-B.Na+、H+、Cl-、HCO3-
C.Na+、NH4+、OH-、Cl-D.H+、K+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,E中装有常见气体,与E装置相连的玻璃导管可根据需要变换长短。
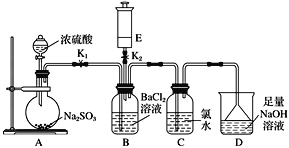
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)A中发生反应的化学方程式是:________________________________________,B中的现象是_____________________________________。
(2)C中的现象是______________写出C中反应的化学方程式:___________________________________。
(3)D的作用是________________________,反应的离子方程式为__________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的无色气体缓缓注入B中,有白色沉淀产生:
①若E是无色有刺激性气味气体,它的分子式为________,产生的白色沉淀是_______________(填化学式)
②若E是无色无味气体,它的分子式为________, 产生的白色沉淀是_______________(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com