
【题目】实验室用下图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略)。

(1)a仪器的名称是:______。
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是_______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:___________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入(填符号)___________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯____溴(填“大于”或“小于”)。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是_____________________。
(6)F处为尾气吸收装置, 写出实验室利用烧碱溶液吸收Cl2的离子方程式__________________________。
【答案】分液漏斗 饱和食盐水 B中长颈漏斗中液面上升,形成水柱 c 大于 E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)装置A中仪器a名称为分液漏斗;故答案为:分液漏斗;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水可以除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱;故答案为:饱和食盐水;B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,故应先检验Cl2能使湿润有色布条褪色,再对氯气进行干燥,然后观察氯气能否使干燥的有色布条褪色,在U形管中应用固体干燥剂, C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,符合要求,故答案为:c;
(4)当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯气能够与溴离子反应生成单质溴,氯气的氧化性强于溴,所以非金属性氯大于溴,故答案为:大于;
(5)打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色,故答案为:E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色;
(6)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;故答案为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL FeI2溶液中逐渐通入Cl2,其中n(I2)、n(Fe3+)随通入n(Cl2)的变化如图所示,下列说法不正确的是
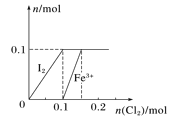
A. 还原性强弱:Fe2+<I-
B. n(Cl2)=0.12 mol时,溶液中的离子主要有Fe2+、Fe3+、Cl-
C. 由图可知,该FeI2溶液的浓度为1mol·L-l
D. n(Cl2)∶n(FeI2)=1∶2时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 验操作和现象 | 实验结论 |
A | 将FeSO4高温灼烧,产生的气体通入盐酸酸化的BaCl2溶液中,产生白色沉淀 | 气体中含有SO3(g) |
B | 向(NH4)2Fe(SO4)2溶液中,滴入新制氯水,后再滴入KSCN溶液,溶液变红 | 原(NH4)2Fe(SO4)2部分或完全被氧化 |
C | 向两支均盛有2mLKI3溶液的试管中分别滴入淀粉溶液和硝酸酸化的AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀 | 原KI3溶液中存在I3- |
D | 向3mL苯中加入1mL液溴,然后加入少量FeBr3充分反应后,产物倒入水中,烧杯底部有褐色油状液体 | 溴苯呈褐色,不溶于水,密度比水大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2 molSO2和1molO2充入 10 L恒容密闭容器中,发生反应:2SO2(g) +O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
2SO3(g) △H=-196 kJ·mol-1。5 min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A. 0~5min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 molSO2和2 molO2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种短周期主族元素x、y、z、d、e、f、 g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01 mol/L)的pH与原子序数的关系如图2所示。
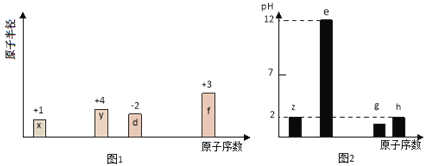
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是____________________。
(2)比较d、e、f的简单离子半径大小为______<______<______(用离子符号表示);y、h 的最高价氧化物对应水化物酸性较强的是__________(用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是________。
A.测等浓度相应氯化物水溶液的pH
B.测两种元素单质的硬度和熔、沸点
C.比较单质做还原剂时失去的电子数目的多少
D.比较两种元素在化合物中化合价的高低
E.比较单质与同浓度盐酸反应的剧烈程度
(4)据报道,最近意大利科学家获得了极具研究价值的z4,其分子结构与白磷分子(P4)的正四面体结构相似。已知断裂1 mol z-z键吸收167 kJ热量,生成1 mol Z≡Z键放出942 kJ热量,请写出z4气体在一定条件下生成z2气体反应的热化学方程式___________________。
(5)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________________________________________。已知eyz含有z2分子中类似的化学键,写出化合物eyz的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是______(填字母)。
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率。平衡时,NH3的转化率α(NH3 )=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com