
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是 (填写编号)。
(2)下列操作合理的是 (填字母)
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |

(1) ab (2) AD (3) 26.10mL (4)3.2mL 4.60mL
解析试题分析:(1)量筒和容量瓶没有“0”刻度;(2)托盘天平精确度为0.1g,不能精确称量10.20克碳酸钠固体;用100mL的量筒量取3.2mL浓硫酸造成的误差较大,应该用10mL的量筒量取,故B、C错误,A、D操作合理;(3)滴定前液面读数为0.00mL,滴定后液面读数为26.10mL,故所用盐酸的体积为26.10ml;(4)量筒刻度自下而上逐渐增大,若甲图中刻度A为4,则B为3,最小刻度为0.2mL,根据液面高度可判断量筒中液体的体积为3.2mL;滴定管刻度自上而下依次增大,乙图中如果刻度D为4,则E为5,最小刻度为0.1mL,由液面高度可判断滴定管中液体体积的读数为4.60mL(注意精确到0.01mL)。
考点:考查常用定量仪器的使用方法。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列实验操作或对实验事实的叙述中,正确的是( )
| A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质 |
| B.向浓硫酸中缓慢加蒸馏水,以稀释浓硫酸 |
| C.常温下,浓硝酸可贮存于铁制或铝制容器中 |
| D.向溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,说明一定含有SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 (填写编号)
①粗盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)①读取滴定管中滴体体积时,仰视液面,读取的体积数 实际体积数(填“>”、“=”或“<”)
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为 g。
③实验需用480mL 0.1mol·L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 ,所称取NaOH固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为c mol/L的标准NaOH溶液对其进行滴定。
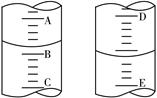
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH) 2 | 5.9×10-15 | 9.4 | CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 | 1.6×10-14 | 9.6 | |
| Fe(OH) 3 | 1.0×10-35 | x |
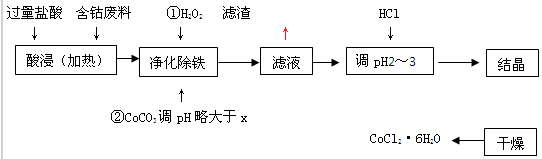
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质。工业上以粗氧化锌生产硫酸锌晶体(ZnSO4·7H2O)的工艺流程如下图所示:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
请回答下列问题:
(1)操作③的名称是 ;
(2)加入适量锌粉的作用为 ;
(3)加入30%H2O2反应的离子方程式是 ;
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(8分)用NaCl固体配制1mol/L的NaCl溶液100mL。
(1)实验室有下列仪器:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥托盘天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取NaCl的质量为 。
(3)在定容时,不小心滴加的蒸馏水超过了刻度线,处理的方法是 ;将NaCl溶液转移到容量瓶后,未对烧杯和玻璃棒进行洗涤,则所得溶液的浓度(填“偏高”或“偏低”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a. 实验1和2探究 ; b. 实验1和3探究反应物浓度对该反应速率的影响; c. 实验1和4探究催化剂对该反应速率的影响。 | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个 ________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com