
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
【答案】C
【解析】
A.在反应中,叠氮化钠里氮的化合价由-1/3价升高到0价,KNO3中的氮由+5价也降到了0价。所以NaN3是还原剂,硝酸钾是氧化剂,A错误;
B.氧化产物和还原产物都是氮气。16mol N2中有1mol N2来自硝酸钾,15molN2来自于NaN3,所以氧化产物与还原产物的物质的量之比为15∶1,B错误;
C.硝酸钾中的氮原子全部被还原,所以硝酸钾的物质的量和被还原的氮原子的物质的量相等。50.5克硝酸钾即0.5mol KNO3参加反应,那么被还原的N即为0.5mol,C正确;
D.从反应可以看出,每转移10mol电子,生成16mol N2,所以转移1mol电子,就会生成1.6mol N2,标准状况下为35.84L,D错误;
故合理选项为C。


科目:高中化学 来源: 题型:
【题目】甲乙丙三种物质间通过一步反应能实现如图转化,下列选项中符合转化关系的是( )
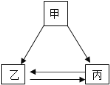
A.甲为NaOH,乙为NaCl,丙为NaNO3
B.甲为CuO,乙为CuCl2,丙为Cu(OH)2
C.甲为Na2CO3,乙为CO2,丙为CaCO3
D.甲为H2SO4,乙为BaSO4,丙为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
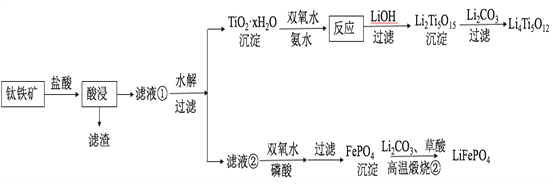
回答下列问题:
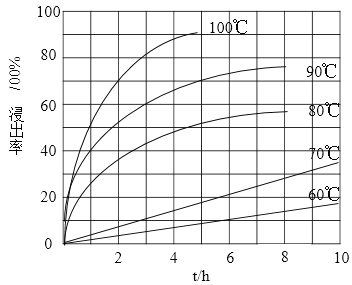
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和氯化铁溶液滴入沸水时,液体变为________色,得到的是________,反应的化学方程式为________________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色________,这表明____________________,这种现象称为________。
(2)向其中加入饱和的氯化钠溶液,发生的现象是____________。
(3)向其中逐滴加入过量稀硫酸,现象是______________,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是____。
②整套实验装置存在一处明显的不足,请指出____。
B装置的作用:_____。

(2)用改正后的装置进行实验,实验过程如下:
①请填写Cl2、Br2、Fe3+氧化性由强到弱的顺序:_____。
②E装置中溶液变黄的原因(请用离子方程式解释)_____。
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因____,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___溶液,若溶液颜色___,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
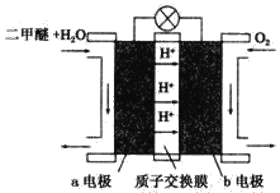
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 某基态原子核外电子排布图为![]() 它违背了泡利原理
它违背了泡利原理
D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com