
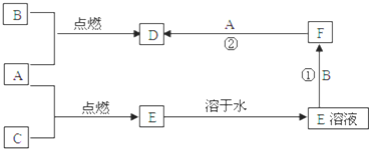
【题目】A、B、C三种常见单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使紫色石蕊先变红后褪色.F的水溶液为浅绿色,其转化关系如图所示,请回答:
(1)![]() 和C燃烧的现象是______.
和C燃烧的现象是______.
(2)![]() 的化学式是______,检验F水溶液中金属阳离子的方法是______.
的化学式是______,检验F水溶液中金属阳离子的方法是______.
(3)反应![]() 的离子方程式是______.
的离子方程式是______.
【答案】安静地燃烧、产生苍白色火焰、瓶口有白雾 FeCl2 先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子 2Fe2++Cl2=2Fe3++2Cl-
【解析】
A溶于水所得的溶液可使石蕊试液先变红后退色,则说明A为Cl2,氯气与水反应生成HCl和HClO,能使石蕊试液先变红后褪色;F的水溶液为浅绿色溶液,说明F中含有Fe2+,能继续和Cl2反应生成D,则D为FeCl3,F为FeCl2,所以B为Fe,则C为![]() ,E为HCl。
,E为HCl。
(1)A为氯气,C为氢气,氢气在氯气中燃烧:H2+Cl2![]() 2HCl,生成的氯化氢气体极易溶于水,所以瓶口上方有白雾,所以燃烧的现象为:安静地燃烧、产生苍白色火焰、瓶口有白雾;
2HCl,生成的氯化氢气体极易溶于水,所以瓶口上方有白雾,所以燃烧的现象为:安静地燃烧、产生苍白色火焰、瓶口有白雾;
(2)F为FeCl2,检验亚铁离子的方法为:先加入KSCN溶液,无明显现象,再加入几滴新制氯水,溶液变成血红色,可说明存在亚铁离子;
(3)②FeCl2具有还原性,能与具有氧化性的Cl2反应生成FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )
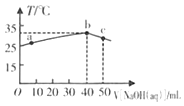
A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
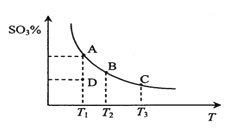
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是
A.氯化钠B.氯化钾
C.氯化铜D.氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
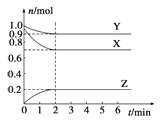
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17gL-1,常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系
;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系![]() 其他无关物质已略去
其他无关物质已略去![]() :
:
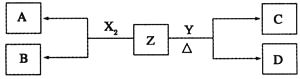
(1)写出单质X2与Z反应的离子方程式:______________________________________。
(2)已知16g单质Y完全燃烧放出148kJ热量。写出热化学方程式:________________。
(3)已知C能与较浓盐酸反应生成能使品红溶液褪色的气体
①D的化学式是:_________;D的水溶液pH>7,原因是![]() 用离子方程式表示
用离子方程式表示![]() :_____________。
:_____________。
②0.1molL-1的D溶液中各离子浓度由大到小的顺序为_______________________。
③将20mL0.5molL-1溶液逐滴加入到20mL0.2molL-1 KMnO4溶液![]() 硫酸酸化
硫酸酸化![]() 中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
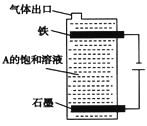
(4)①石墨和铁做电极,用隔膜电解槽电解A的溶液,阳极可产生X2。则铁做_________极。
②按下图电解A的饱和溶液,写出该电解池中较长时间内发生反应的总反应方程式: ________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是: ( )
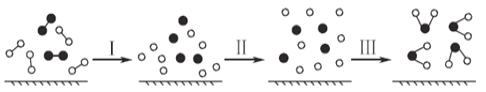
A.过程Ⅰ是吸热过程B.该反应的能量转化形式只能以热能的形式进行
C.过程Ⅲ一定是放热过程D.该反应过程所有旧化学键都断裂,且形成了新化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
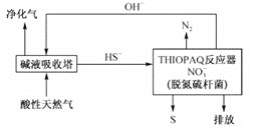
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
Ⅰ(1).某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的现象是___________________________。反应的离子方程式为__________________。
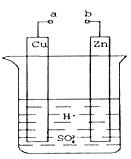
(2).a和b用导线连接,Cu极为原电池_____(填“正”或“负”)极,电极反应式是__________,发生__________(填“氧化”或“还原”)反应。
Ⅱ(3).有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?________(填“是”或“否”)。
(4).将a与直流电源的正极相连并把Cu换成石墨电极,b与直流电源的负极相连,则石墨电极为_________极(填“阳”或“阴”)发生__________(填“氧化”或“还原”)反应,溶液中H+移向_____(填“C”或“Zn”)极。该过程的总反应方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com