
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3,放出92kJ热量____________________。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量________。
【答案】 N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
2NH3(g) ΔH=-92kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
【解析】(1)34gNH3的物质的量为:34g÷17gmol-1=2mol,N2与H2反应生成生成2molNH3,放热92kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ/mol。
2NH3(g) ΔH=-92kJ/mol。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列有关说法正确的是
A. CO2属于大气污染物
B. 酸雨是pH小于7的雨水
C. CO2、NO2或SO2都会导致酸雨的形成
D. 大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有毒气体的减排和处理是工业生产中的重要课题。
(1)Na2CO3溶液可吸收尾气SO2,反应过程中溶液组成变化如下图。

①SO2分子属于________ (选填“极性”或“非极性”) 分子,以上反应_____(选填“能”或“不能”) 说明S、C两种元素的非金属性强弱。
②A点反应的离子方程式是_____。
(2)汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

①已知Ba(NO3)2分解产物含有两种气体,由上图信息,写出Ba(NO3)2分解反应的化学方程式_______。
②下列说法正确的是__________
A.稀燃过程的目的是固氮
B.在整个过程中,Pt和BaO都可看作催化剂
C.汽车尾气若不处理,其中的氮氧化物等可能形成光化学烟雾
D.富燃过程中,NO2与CO反应,氧化产物和还原产物的物质的量之比为1:1
③实验测出,每千克CxHy (以液体C8H18为例) 在O2中充分燃烧生成液态水,放出4.78×104kJ热量。写出C8H18燃烧热的热化学反应方程式______________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+ H2O =2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______%。
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=5 :3时,可通入一定量的空气,同温同压下,V(空气): V(NO)=___________ (空气中氧气的体积含量大约为20%)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1 mol·L-1的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是( )
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,对下列事故或药品的处理正确的是( )
A. 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B. 金属钠着火燃烧时,用泡沫灭火器灭火
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D. 含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(已知A为单质):将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:

(1)红褐色胶体中F粒子直径大小的范围:___________________。
(2)写出A、B、H的化学式_____________、________、_________。
(3)①H2O2分子的电子式为_____________________。
②写出C的酸性溶液与双氧水反应的离子方程式:___________。
(4)鉴定E中阳离子时,可先加入_________溶液,再加热使之产生气体。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示: 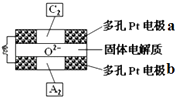
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置 .
(2)化合物乙的电子式为 , 用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式: .
(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为(填a或b);O2﹣流向极(填“正”或“负”);该电池的正极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化。
(1)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)![]() 2ClF3(g) 的△H=_____________ kJ·mol—1 。
2ClF3(g) 的△H=_____________ kJ·mol—1 。
(2)如图是乙烷、二甲醚燃烧过程中的能量变化图。

请回答下列问题:
①乙烷的燃烧热ΔH=____kJ·mol-1。
②等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物时放出的热量__(填“多”或“少”)。
③根据题图写出二甲醚完全燃烧时的热化学方程式_____________。
(3)实验室用50mL 0.50mol·L﹣1HCl与50mL 0.55mol·L﹣1NaOH溶液测定中和热。
①若改用60mL HCl进行实验,与原实验相比,所放出的热量____(填“相等”或“不相等”,忽略实验本身误差,下同),所求中和热_____(填“相等”或“不相等”,)。
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求中和热数值会___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com