
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为________________________;[Cu(NH3)4]SO4·H2O中,不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为___________。
(2)乙醇分子中C原子轨道杂化类型为___________,H2O与H+以配位键形成H3O+,则H3O+的空间构型为__________(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为____________________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
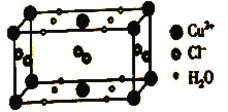
【答案】 1s22s22p63s23p63d9 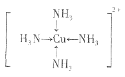 sp3 三角锥形 N>O>S CuCl2·2H2O
sp3 三角锥形 N>O>S CuCl2·2H2O
【解析】试题分析:(1)Cu2+的原子序数为27,结合能量最低原理书写电子排布式;[Cu(NH3)4]2+中Cu2+与NH3通过4个配位键结合;(2)乙醇分子中C都形成4个单键;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能大于O;同主族元素从上到下第一电离能减小;(4)根据均摊法计算晶胞的化学式。
解析:(1)Cu2+的原子序数为27,根据能量最低原理,Cu2+的电子排布式是1s22s22p63s23p63d9;[Cu(NH3)4]2+中Cu2+与NH3通过配位键结合,[Cu(NH3)4]2+的结构可用示意图表示为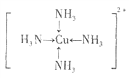 ;(2)乙醇分子中C都形成4个单键,所以C原子轨道杂化类型为sp3;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子,所以H3O+的空间构型为三角锥形;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能N大于O;同主族元素从上到下第一电离能减小,第一电离能O>S,所以第一电离能N>O>S;(4)根据均摊法,Cu2+数是
;(2)乙醇分子中C都形成4个单键,所以C原子轨道杂化类型为sp3;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子,所以H3O+的空间构型为三角锥形;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能N大于O;同主族元素从上到下第一电离能减小,第一电离能O>S,所以第一电离能N>O>S;(4)根据均摊法,Cu2+数是![]() =2,Cl-数是
=2,Cl-数是![]() ,水分子数是
,水分子数是![]() ,所以晶胞的化学式是CuCl2·2H2O。
,所以晶胞的化学式是CuCl2·2H2O。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列关于药物的说法正确的是( )
A.药物的服用剂量越大,治疗效果越明显
B.包装上印有“OTC“标志的药品属于处方药
C.氢氧化铝可作为抑酸剂,用于治疗胃酸过多
D.长期大量服用阿司匹林可预防某些疾病,没有副作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
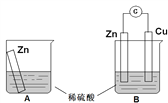
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
Ⅰ | Ⅱ | Ⅲ | |
实验操作 示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(1)实验Ⅰ的作用是_______________。
(2)实验Ⅲ中反应的化学方程式为_______________。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______________。
(4)在一定温度下,10 mL 0.40 mol/L,H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。(计算结果精确到0.001)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:2HI(g) ![]() H2(g)+I2(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
H2(g)+I2(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
A.HI、H2、I2的浓度相等
B.HI、H2、I2的浓度不再发生变化
C.HI、H2、I2在密闭容器中共存
D.容器内气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期主族元素z、e、g、h,其最高价氧化物对应水化物溶液(浓度均为0.01molL﹣1)的pH与原子序数的关系如图所示。下列说法正确的是

A. 离子半径大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有离子键有含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值 h >g> z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“观察DNA和RNA在细胞中的分布”实验中,使用盐酸的目的是 ( )
①改变细胞膜的流动性
②改变细胞膜的通透性
③改变细胞膜的化学组成
④将DNA与蛋白质分离
⑤将RNA与蛋白质分离
⑥利于RNA与染色剂结合
⑦利于蛋白质与染色剂结合
⑧利于DNA与染色剂结合
A.①④⑥ B.②④⑧ C.③⑤⑦ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是

A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“观察DNA和RNA在细胞中的分布”的实验中,没有用到的试剂是 ( )
A.质量分数为0.9%的NaCl溶液
B.质量分数为8%的盐酸
C.甲基绿吡罗红染色剂
D.质量分数为50%的酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com