
【题目】某含C、H、O三种元素的未知物M的相对分子质量小于100,经燃烧分析实验测定该未知物碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是
A. M的分子式为CH2O B. M的实验式为CH30
C. M不可能是2-羟基丙酸 D. M可能是饱和一元羧酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: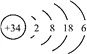 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,其中N的化合价为________,是_____________(用“电解质”或者“非电解质”填空)。NaN3受热分解产生N2和Na,则该反应方程式为: ________。已知常温常压下气体摩尔体积为24.5L/mol,则在常温常压下,反应130g NaN3能产生_____________L的N2。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________________(已知该反应为置换反应)。若已知2.3gNa完全反应,转移的电子物质的量为____________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KC1和Na2O,请用单线桥表示该反应电子转移:KClO4+8Na= KCl+4Na2O_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业生产流程如下:
海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2·6H2O
MgCl2·6H2O![]() MgCl2
MgCl2![]() Mg
Mg
下列说法错误的是( )
A. 此法的优点之一是原料来源丰富
B. 该提取镁的过程中涉及置换、分解、复分解和氧化还原反应
C. 步骤①②③的目的是从海水中提取无水MgCl2
D. 步骤②中加盐酸的离子方程式为Mg(OH)2+2H+Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为__________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
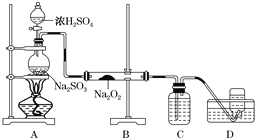
①盛放浓H2SO4仪器名称为____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________________、Na2O2+SO2===Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
A.③②⑤④B.③②④①⑥C.③②④⑥D.②④①⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com