
【题目】下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | Ⅲ A | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为 。
(4)从⑤到⑧的元素中, 离子半径最小(填离子符号)。
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
【答案】(1)12C (1分)
(2)HClO4;KOH;(2分)
(3)2Al+2OH-+2H2O=2AlO![]() +3H2↑ (2分)
+3H2↑ (2分)
(4)Al3+;(1分)
(5)![]() (2分)
(2分)
(6)C(1分)
【解析】试题分析:(1)被选作相对原子质量标准的核素是12C。
(2)同周期由左向右元素的金属性逐渐减弱,非金属性逐渐增强,最高价氧化物水化物的碱性逐渐减弱,酸性逐渐增强;同主族由上到下元素的金属性逐渐增强,非金属性逐渐减弱,最高价氧化物水化物的碱性逐渐增强,酸性逐渐减弱。结合题给元素的位置关系知在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH。
(3)最高价氧化物是两性氧化物的元素为铝元素,铝单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2—+3H2↑。
(4)第三周期元素由左向右阳离子半径逐渐减小,阴离子半径逐渐减小,阴离子半径大于阳离子半径,故Al3+离子半径最小。
(5)元素③为氧元素,⑤为钠元素,二者形成的具有强氧化性的化合物为过氧化钠,电子式为![]() 。
。
(6)A、金属钠不能从氯化镁溶液中置换出金属镁,但钠的金属性比镁强,错误;B、元素最高价氧化物对应水化物的碱性越强,金属性越强,与最高价氧化物水化物的溶解性无关,错误;C、单质与水或酸反应,反应越剧烈,越容易置换出氢,金属性越强,正确;D、元素的金属性强弱与氧化物的颜色深浅无关,错误,选C。


科目:高中化学 来源: 题型:
【题目】某元素的同位素![]() ,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)X元素在周期表中的位置是_____________;
(2)写出XCl2的电子式_________________;
(3)把X的单质放入水中,写出反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
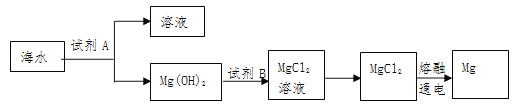
①Mg(OH)2转化为MgCl2的离子方程式是 ,
②将MgCl2溶液在 气流中 、蒸发、冷却、结晶制得MgCl2晶体。
③由无水MgCl2制取Mg的化学方程式是________________________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
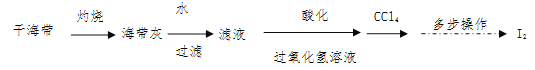
①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式: 。
③反应结束后,可加入 作萃取剂,采用萃取-分液的方法从碘水中提取碘。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作和实验事故处理不正确的是
A. 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检査是否漏气
B. 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗
C. 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
D. 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.只要含有金属元素的化合物一定是离子化合物
B.全部元素都由非金属元素构成的化合物一定是共价化合物
C.离子化合物一定是电解质
D.共价化合物一定是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.8g的甲烷含有0.5NA共价键
B.乙醇与水任意比互溶与氢键有关
C.离子化合物中不可能有共价键
D.所有物质都存在范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。

回答下列问题:
(1)装置B的作用是_____________;装置C的作用是____________;装置E中碱石灰的作用是_______。
(2)装置D中发生反应的化学方程式是:_________________。
(3)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛是常用的一种食用香精。存在下列转化关系:
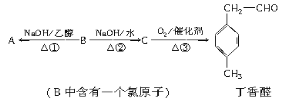
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.陈年老酒的香气浓是因为乙醇的特殊的香气
B.钠与乙醇的反应比钠与水的反应激烈,发生了取代反应
C.乙烯是重要的化工原料,乙烯的产量可以用来衡量一个国家的石油化工水平
D.乙烯分子所有原子都在同一平面上,丙烯也是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com