
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式______________________________________________
________________________________________________________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液混合而得,则溶液M的pH____________7(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为________________________________________________________________________。
已知Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________ mol·L-1。(忽略混合后溶液体积的变化)
(3)若溶液M有下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为____________;pH由大到小的顺序为____________。(请填写序号)
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于”“等于”“小于”或“均有可能”)。
科目:高中化学 来源: 题型:
【实验探究】 在实验室完成如下实验,并回答以下问题。在锥形瓶内装入10mL 1mol / L的A1C13溶液,逐滴滴人3 mol / L的NaOH溶液至过量,边滴边摇晃锥形瓶。
(1) 请描述实验现象
(2) 开始发生反应的化学方程式:
加入过量NaOH溶液后发生的反应的离子方程式:
(3) 生成沉淀物的最大质量是
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是( )
A.一定有SO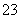 离子
离子
B.一定有CO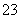 离子
离子
C.不能确定Cl-离子是否存在
D.不能确定HCO 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
在盐类发生水解的过程中,正确的说法是
A.盐的电离平衡被破坏
B.水的电离程度逐渐增大
C.溶液的pH发生了较大改变
D.水解后溶液一定呈酸性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成,①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。
下列各项排序正确的是
A.c(NH ):①<③<②<④
):①<③<②<④
B.溶液中c(H+):①<③<②<④
C.pH:②<①<③<④
D.c(NH3·H2O):①<③<④<②
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.2 mol·L-1H2SO3溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示。(其中Ⅰ表示H2SO3,Ⅱ代表HSO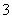 、Ⅲ代表SO
、Ⅲ代表SO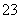 )。根据图示判断正确的是
)。根据图示判断正确的是
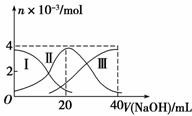
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-7
B.当V(NaOH)=20 mL时:c(Na+)>c(HSO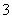 )>c(H+)>c(SO
)>c(H+)>c(SO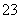 )>c(OH-)
)>c(OH-)
C.当V(NaOH)=40 mL时2c(Na+)=c(SO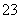 )
)
D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高
查看答案和解析>>
科目:高中化学 来源: 题型:
图中A~J均为有机化合物,根据图中的信息
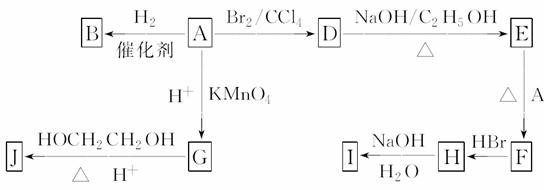
请回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________________。
(3)由A生成D的反应类型是____________,由D生成E的反应类型是____________。
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1NaOH溶液完全中和,J是一种高分子化合物,则由G转化为J的化学方程式为___________________________________
________________________________________________________________________。
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
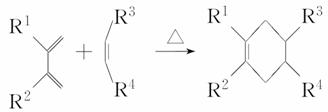
则由E和A反应生成F的化学方程式为_____________________________________。
(6)H中含有的官能团是________________,I中 含有的官能团是_______
含有的官能团是_______ _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了测定三聚氰胺的分子式和结构简式设计了如下实验。他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。现有12.6 g三聚氰胺晶体按下图所示实验装置反应(假设三聚氰胺完全转化成产物)。
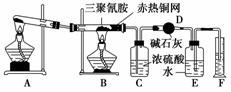
(1)写出A装置中发生反应的化学方程式:______________________________________________。
(2)C装置能不能与D装置互换?________(填“能”或“不能”),理由是________________________________________。
(3)当B装置中反应完全后,读取F中水的体积,实验操作顺序为________(填序号)。
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如下:
| 仪器 | C | D |
| 实验前 | 101.0 g | 56.0 g |
| 实验后 | 106.4 g | 69.2 g |
经测定,收集到的气体折合成标准状况下的体积为6.72 L。
①利用上述实验数据,通过计算可知三聚氰胺的实验式为________。
②三聚氰胺的分子式为________。
③若装置中没有铜网,则对测定结果的影响是_______________________________________________。
(5)已知氰酸(HCN)的结构简式为H—C≡N,氰胺的结构简式为H2N—C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com